الورم الأرومي الدبقي (GBM) هو الشكل الأكثر فتكًا والأكثر عدوانية من سرطان الدماغ. تتكرر جميع الأورام تقريبًا بعد العلاج، حيث تتحول الخلايا الباقية إلى أشكال أكثر مرونة بمرور الوقت لمقاومة المزيد من العلاجات. ولمواجهة هذا التحدي، قام العلماء في جامعة ليدز صمموا ماصة نانوية جديدة مزدوجة البرميل واستخدموها لفحص مسارات خلايا GBM الحية الفردية أثناء تغيرها استجابةً للعلاج.
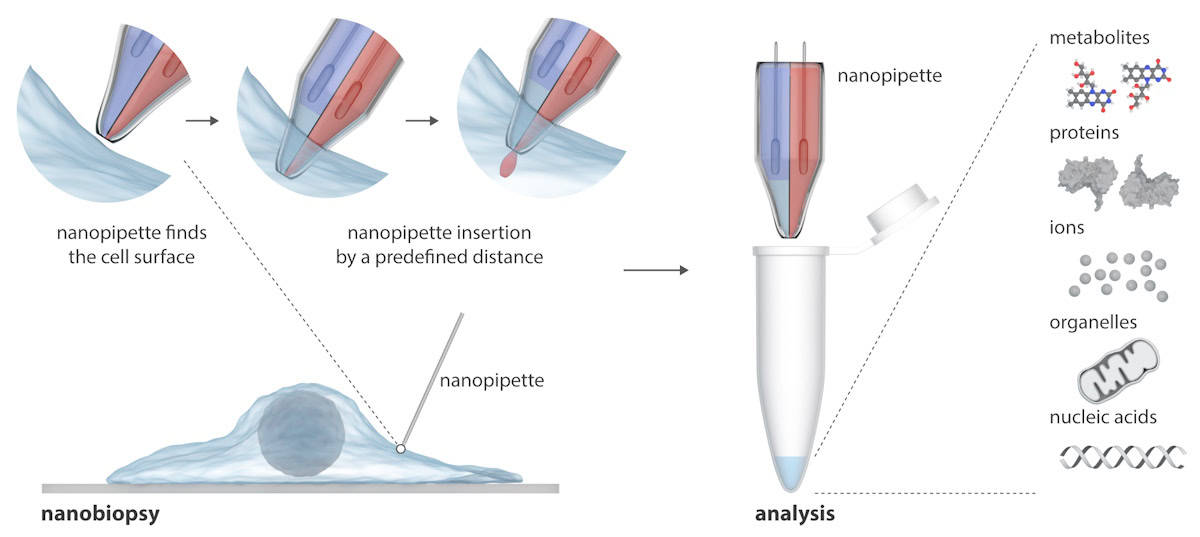
تتكون الماصة النانوية من إبرتين نانوية يمكنها حقن جزيئات خارجية في وقت واحد داخل الخلية واستخراج عينات السيتوبلازم منها. تم دمج الماصة النانوية في مجهر التوصيل الأيوني الماسح (SICM) لإجراء خزعات نانوية للخلايا الحية في المزرعة. على عكس التقنيات الحالية لدراسة الخلايا المفردة، والتي عادة ما تدمر الخلية، يمكن للماصة النانوية أخذ خزعات متكررة من خلية حية دون قتلها، مما يتيح إجراء دراسات طولية لسلوك الخلية الفردية مع مرور الوقت.
الكتابة في علم السلفيوضح الباحثون أن SICM يعمل عن طريق قياس التيار الأيوني بين قطب كهربائي مُدخل في ماصة زجاجية نانوية وقطب مرجعي مغمور في محلول إلكتروليتي يحتوي على الخلايا. يتم إجراء خزعة النانو عندما يتدفق تيار أيوني عبر الثقب النانوي عند طرف الماصة النانوية بعد تطبيق الجهد الكهربي بين القطبين الكهربائيين. في الماصة النانوية ذات البرميل المزدوج، يعمل البرميل الواحد بمثابة حقنة كهروكيميائية لإجراء عمليات الاستخراج السيتوبلازمي؛ والثاني يحتوي على محلول إلكتروليت مائي يوفر تيارًا أيونيًا مستقرًا لتحديد المواقع بدقة وحقن النانو قبل إجراء الخزعة النانوية.
تتيح المنصة شبه الآلية استخراج كميات من الفيمتوليتر من السيتوبلازم والحقن المتزامن في الخلايا الفردية. توفر المنصة تحديد الموقع الآلي للماصة النانوية باستخدام التحكم في ردود الفعل (ينخفض التيار الأيوني عندما تقترب الماصة النانوية من العينة)، في حين يشير الكشف عن التوقيعات الحالية المعينة إلى اختراق الغشاء الناجح لخلية واحدة.
الدراسات الطولية
كدليل على مفهوم قدرة المنصة، أجرى الباحثون خزعة نانوية طولية لخلية GBM (وذريتها)، وتغيرات التعبير الجيني على مدار 72 ساعة. قاموا بإجراء خزعة النانو قبل العلاج، وأثناء العلاج بالعلاج الإشعاعي والعلاج الكيميائي، وبعد العلاج.
"طريقتنا قوية وقابلة للتكرار، مما يسمح باختراق الغشاء والحقن النانوي عبر أنواع مختلفة من الخلايا ذات خصائص ميكانيكية متميزة"، كما كتب الباحثون الرئيسيون المشاركون. لوسي ستيد و باولو أكتيس. "متوسط معدل نجاح الحقن النانوي هو 0.89 ± 0.07. ومن ثم يتم استخراج mRNA داخل الخلايا.
قام الباحثون بدراسة استجابة خلايا GBM للعلاج القياسي بـ 2 غراي من الإشعاع و30 ميكرومتر من تيموزولوميد. قاموا بتتبع الخلايا الفردية وذريتها بصريًا على مدار 72 ساعة، مع بقاء 98% منها في مجال رؤية المجهر خلال هذا الإطار الزمني - وهو عامل مهم عند استهداف إجراء التحليل الطولي.

في اليوم الأول، أخذ الباحثون خزعة وحقنوها بصبغة الفلورسنت وقاموا بتصوير كل خلية. في اليوم الثاني، تلقت نصف الخلايا التشعيع والعلاج الكيميائي، في حين كانت الخلايا الأخرى بمثابة الضوابط. تم تصوير جميع الخلايا في اليوم الثاني والثالث، وتم أخذ خزعة منها وحقنها مرة أخرى في اليوم الرابع.
في الخلايا التي خضعت للخزعات النانوية في اليوم الأول، كان البقاء على قيد الحياة متشابهًا بين الخلايا المعالجة وغير المعالجة، وكانت معدلات انقسام الخلايا مماثلة في المجموعتين. بعد 1 ساعة، نجا 72% من الخلايا الضابطة غير المعالجة (التي لم يتم أخذ خزعة منها)، مقارنة بـ 63% من الخلايا المعالجة التي تم أخذ خزعة منها. لم يكن هناك اختلاف في معدلات الوفاة اللاحقة لأنواع الخلايا الفرعية في اليوم الأول، بغض النظر عن العلاج. ومع ذلك، فإن نسبة أكبر بكثير من الخلايا غير المعالجة قامت بتبديل النوع الفرعي مع مرور الوقت، أو أنتجت ذرية بنوع فرعي مختلف، عن الخلايا المعالجة.
وكتب الباحثون: "يشير هذا إلى أن الخلايا غير المعالجة تكون أكثر مرونة بشكل ملحوظ على مدار ثلاثة أيام من الخلايا المعالجة". "كشفت نتائج النمط الظاهري للخلية في اليوم الأول والعينات الطولية أن الخلايا المعالجة تميل إلى الحفاظ على نفس النمط الظاهري أثناء العلاج، في حين أن الخلايا غير المعالجة أكثر عرضة لتبديل حالة النسخ على مدى 1 ساعة، مما يشير إلى أن العلاج إما يحفز أو يختار الاستقرار النسخي العالي". في خط خلايا GBM هذا."
يقول ستيد: "يعد هذا إنجازًا كبيرًا". "إنها المرة الأولى التي نمتلك فيها تقنية تمكننا من مراقبة التغييرات التي تحدث بعد العلاج، بدلاً من مجرد افتراضها. سيوفر هذا النوع من التكنولوجيا طبقة من الفهم لم نكن نمتلكها من قبل. وهذا الفهم الجديد والبصيرة سيؤديان إلى أسلحة جديدة في ترسانتنا ضد جميع أنواع السرطان.

جراحة النانو الميكانيكية تهاجم سرطان الدماغ العدواني
الفريق مقتنع بأن قدرة هذه المسبارات النانوية متعددة الاستخدامات على الوصول إلى البيئة داخل الخلايا بأقل قدر من التعطيل تحمل القدرة على "إحداث ثورة في التشخيص الجزيئي والعلاجات الجينية والخلوية".
يقول أكتيس: "سيركز عملنا المستقبلي على زيادة إنتاجية التكنولوجيا بحيث يمكن تحليل المزيد من الخلايا". عالم الفيزياء. "نحن نعمل على تحسين بروتوكولات تحليل الحمض النووي الريبي المستخرج من الخلايا حتى يمكن جمع المزيد من المعلومات البيولوجية. كما أننا حريصون جدًا على دراسة النماذج البيولوجية الأكثر تقدمًا لسرطان الدماغ استنادًا إلى الخلايا والعضيات المشتقة من المريض.
- محتوى مدعوم من تحسين محركات البحث وتوزيع العلاقات العامة. تضخيم اليوم.
- PlatoData.Network Vertical Generative Ai. تمكين نفسك. الوصول هنا.
- أفلاطونايستريم. ذكاء Web3. تضخيم المعرفة. الوصول هنا.
- أفلاطون كربون، كلينتك ، الطاقة، بيئة، شمسي، إدارة المخلفات. الوصول هنا.
- أفلاطون هيلث. التكنولوجيا الحيوية وذكاء التجارب السريرية. الوصول هنا.
- المصدر https://physicsworld.com/a/single-cell-nanobiopsy-explores-how-brain-cancer-cells-adapt-to-resist-treatment/