ارسال شده توسط راب پاکارد on ژوئن 28، 2023
قالب و محتوای مورد نیاز برای پیش ارسال FDA تغییر نکرده است، اما راه اندازی FDA PreSTAR همه چیز را تغییر داده است.
[محتوای جاسازی شده]
پیش ارسال FDA چیست؟
An FDA pre-submission aims to get answers to questions you have about a future FDA submission. The pre-submission may consist of one large PDF document or multiple PDF documents. In your pre-submission, you must select either an email response or an email response with a teleconference. One advantage of choosing a teleconference is that you can ask clarifying questions during a one-hour teleconference with the FDA, but you are responsible for submitting draft meeting minutes to the FDA within 15 days of the teleconference. If you select an email response, you do not need to provide meeting minutes to the FDA. On July 5, 2023, we are kicking off our new 4-part FDA pre-submission webinar series. This will be the Ultimate FDA pre-submission training. Do not miss it.
تفاوت بین ارسال پیش از FDA و ارسال Q چیست؟
هر پیش ارسالی FDA یک ارسال Q است، اما همه ارسال های Q پیش ارسالی نیستند. الگوی جدید PreSTAR در حال حاضر به یک پیش ارسال FDA محدود شده است، اما این الگو بعداً به انواع دیگر Q-subs گسترش خواهد یافت. الگوی پیش از ارسال FDA (یعنی PreSTAR) نسخه بتای 0.1 برای پاسخ به سؤالات بررسی تعاملی FDA ضروری نیست. فقط به Lead Reviewer ایمیل بزنید (محدودیت اندازه فایل برای ایمیل 25 مگابایت است).
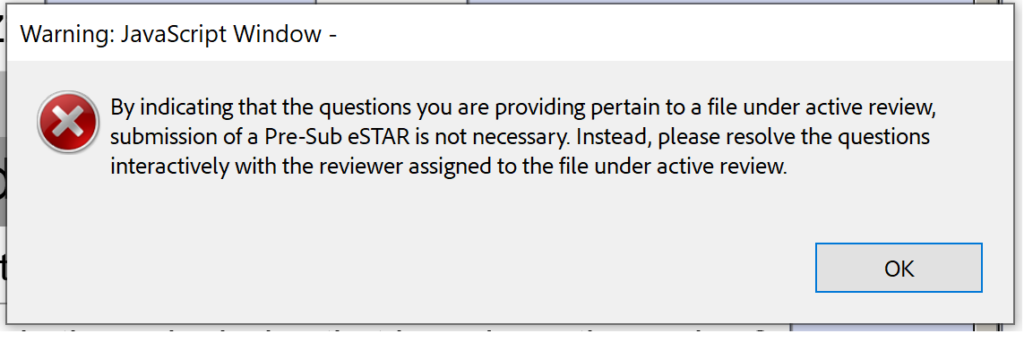
متأسفانه، نسخه بتا 0.1 نیز برای جلسات ارسال در بررسی (SIR) یا پاسخ به IDE در طول یک بررسی تعاملی آماده نیست.
13 نوع دیگر از ارسالها ممکن است از ارسالهای Q سود ببرند:
- درخواستهای ارسال (SIR)
- مطالعه تعیین خطر
- جلسات اطلاع رسانی
- درخواستهای نامگذاری دستگاه پیشرفت
- جلسات اطلاع رسانی
- جلسه 100 روز PMA
- جلسات توافق و تصمیم گیری
- موارد ارسالی مرتبط با برنامه STeP
- درخواست طبقه بندی لوازم جانبی
- درخواست بازخورد FDA در مورد سؤالات خاص یا موضوعات خط مشی مقطعی
- درخواستهایی برای شناسایی پایگاههای اطلاعاتی انواع ژنتیکی در دسترس عموم
- جلسات توافق محصول ترکیبی (CPAM) و
- بازخورد در مورد مشاهدات بازرسی FDA 483.
ما انتظار داریم که الگوی PreSTAR در آینده برای درخواست 513(g) در دسترس باشد زیرا قبلاً برای این منظور تأیید شده است.
شماره ارسال Q چیست؟
به تمام موارد ارسالی Q، یک شماره سند که با "Q" شروع می شود، پس از دریافت (یعنی Qyyxxxx) اختصاص داده می شود. قالب شماره شامل 2 رقم (یعنی "yy") برای سال ارسال (به عنوان مثال، "23" برای سال 2023) و 4 رقم (یعنی "xxxx") است که شماره ترتیبی زیر است که توسط FDA برای آن سال تقویمی. بنابراین، اولین Q-submission دریافت شده توسط FDA در ژانویه 2023 Q230001 است و معمولاً سالانه بین 3,500 تا 4,000 ارسال جدید دریافت می شود. اگر دستگاه موضوع در یک ارسال Q قبلی ارسال شده باشد، از شماره سند اصلی مجددا استفاده می شود و یک شماره تکمیلی اضافه می شود (یعنی Qyyxxx/S001، Qyyxxx/S002، و غیره). شماره گذاری Q-submission با جزئیات بیشتر در بخش توضیح داده شده است راهنمای FDA 2023.
آیا FDA برای ارسال های Q هزینه ای دریافت می کند؟
پیش از ارسال FDA نیازی به پرداخت هزینه کاربر FDA (یعنی 0 دلار) ندارد.
یک پیش ارسال FDA چقدر طول می کشد؟
روزهای له کردن جدول زمانی گذشته است. جدول زمانی است 70-75 روزهای تقویم. در 5 اکتبر 2022، MDUFA V مورد تایید قرار گرفت. به عنوان یکی از اهداف تصمیم MDUFA V، FDA وظیفه دارد تا زمان پاسخگویی به سؤالات پیش فرعی را در 70 روز برای 90 درصد درخواستهای پیش فرعی کاهش دهد. FDA موظف است تا مارس 2024 به این هدف دست یابد. اگر آنها موفق باشند، FDA در سال 59 تعداد 2024 نفر افزایش در بودجه خود دریافت خواهد کرد. این تقریباً یک انگیزه 19 میلیون دلاری برای پاسخ به سؤالات جلسه قبل از ارسال در 70 سال است. روزها. برای انعکاس این اهداف تصمیم گیری جدید MDUFA V، FDA آن را به روز کرد راهنمای Q-Sub سندی برای منعکس کردن تاریخ هدف 70 روز برای پاسخ ایمیل و 75 روز برای جلسات کنفرانس از راه دور. FDA همچنین پورتال همکاری مشتری (CCP) را برای تسهیل ردیابی مهلت های پیش از ارسال FDA به روز کرد.
FDA PreSTAR چیست؟
در گذشته، شما باید سند(های) خود را برای پیش ارسال FDA ایجاد میکردید. برخی از افراد یک سند PDF بزرگ را ایجاد می کنند که به بخش ها تقسیم شده است، در حالی که برخی دیگر اسناد PDF جداگانه برای هر یک از الزامات راهنمای پیش از ارسال FDA ایجاد می کنند. در 6 ژوئن 2023، FDA نسخه بتا (یعنی 0.1 نسخه) یک قالب PDF جدید (یعنی FDA PreSTAR). این قالب جدید PreSTAR مزایای متعددی را برای FDA فراهم می کند:
- هر شرکتی از یک قالب استفاده می کند،
- الگو به طور خودکار تأیید می کند که پیش ارسال شامل همه عناصر مورد نیاز است، و
- گنجاندن عناصر اختیاری شرکت ها را تشویق می کند تا جزئیات بیشتری از دستگاه را نسبت به آنچه که در غیر این صورت ارائه می کنند ارائه دهند.
PreSTAR همچنین از ارسال کنندگان سود می برد:
- هرگز عناصر مورد نیاز پیش از ارسال FDA را فراموش نخواهید کرد،
- شما هرگز مجبور نیستید یک eCopy FDA را تأیید کنید، و
- فرمت و رابط کاربری مشابه به شما آموزش می دهد که از FDA eSTAR استفاده کنید.
توجه: 1 اکتبر 2023، آخرین مهلت اجرای FDA eSTAR است.
آیا باید از قالب PreSTAR استفاده کنید؟
جواب منفی. نسخه PreSTAR 0.1 یک نسخه بتا و 100٪ اختیاری است. با این حال، من آن را بهتر از قالب های خودم دوست دارم. تیم طراحی شما همچنان میتواند اسناد فردی برای دفترچه راهنمای کاربر، توضیحات دستگاه و طرح آزمایشی داشته باشد. ما سند را با استفاده از دکمه "افزودن پیوست" پیوست می کنیم (به تصویربرداری صفحه زیر مراجعه کنید).

الگوی PreSTAR توسط Patrick Macatangga، مهندس ابزار و قالبها که در FDA در تیم ابزارها و قالبهای چرخه زندگی کار میکند، ساخته شده است. برای کمک به اینکه سوالات مربوط به الگو را به کجا هدایت کنیم، او پیشنهاد کرد:
- اگر سؤال یا بازخوردی در مورد استفاده داوطلبانه از eSTAR برای دستگاههای پزشکی تنظیمشده توسط CDRH دارید، یا اگر سؤالات کلی در مورد دستگاههای پزشکی دارید، لطفاً با بخش آموزش صنعت و مصرف کننده (DICE).
- در صورت مشاهده هرگونه نقص یا خطا در قالب eSTAR برای دستگاه های پزشکی که توسط CDRH تنظیم شده است، لطفاً با [ایمیل محافظت شده].
- اگر در مورد 510(k)s، درخواستهای De Novo، یا درخواستهای ارسال زودهنگام برای دستگاههای پزشکی که توسط CDRH تنظیم شدهاند، سؤالی دارید، لطفاً با [ایمیل محافظت شده].
چگونه یک eCopy ارسال می کنید؟
شما می توانید یک نسخه الکترونیکی FDA را بر روی رسانه های الکترونیکی (به عنوان مثال، درایو فلش USB) ارسال کنید و آن را از طریق FedEx به مرکز اسناد FDA در آدرس زیر ارسال کنید: سازمان غذا و دارو، مرکز تجهیزات و سلامت رادیولوژیک، مرکز پست الکترونیکی، 10903 خیابان نیوهمپشایر، ساختمان. 66، rm. G609، بهار نقره ای، MD 20993-0002. با این حال، شما همچنین می توانید یک eCopy FDA را از طریق یک مرورگر وب ارسال کنید (به عنوان مثال، CCP… به بخش بعدی در مورد نحوه ارسال PreSTAR مراجعه کنید).
اگر به جای FDA PreSTAR یک eCopy را از طریق CCP ارسال می کنید
چگونه یک PreSTAR ارسال می کنید؟
شما دو گزینه برای تحویل پیش ارسال FDA دارید:
- پیش فرعی را در رسانه الکترونیکی (مثلاً درایو فلش USB) ذخیره کرده و از طریق FedEx به FDA ارسال کنید، و
- پیش فرعی را در پورتال جدید همکاری مشتری FDA (CCP) آپلود کنید.
[محتوای جاسازی شده]
همانطور که از ویدیوی بالا می توانید حدس بزنید، ما فقط از گزینه 2 برای پیش ارسال های FDA استفاده می کنیم. برای گزینه 2، می توانید یک eCopy (ذخیره شده به عنوان یک فایل فشرده) یا یک PreSTAR (در قالب PDF اصلی) آپلود کنید. تصویر زیر نحوه انجام این کار را به شما نشان می دهد، اما فرآیند آپلود معمولاً حدود یک دقیقه طول می کشد – بسته به اندازه فایل و پهنای باند شما. تو می توانی ثبت نام برای حساب CCP خود در چند ثانیه.

مراحل پیش از ارسال چیست؟
آماده سازی و آپلود درخواست جلسه قبل از ارسال FDA تنها اولین مرحله از این فرآیند است. شما یک ایمیل خودکار دریافت خواهید کرد که تأیید میکند پیشفرض شما با موفقیت آپلود شده است، و سپس یک نامه خودکار از طریق ایمیل دریافت خواهید کرد که شماره Q-sub اختصاص داده شده را به شما میدهد. همچنین یک ایمیل خودکار دریافت خواهید کرد که به شما اطلاع میدهد که پیشارسال پذیرفته شده است، یا در صورت نیاز به تغییرات، بازبینیکننده FDA با شما تماس خواهد گرفت. بازبینی کننده FDA که منصوب شده است معمولاً در سه هفته اول از طریق ایمیل با شما تماس می گیرد تا در صورت درخواست شما یک کنفرانس تلفنی را برنامه ریزی کند، اما تاریخ/زمان ارائه شده معمولاً با در دسترس بودن تیم FDA مطابقت ندارد و ممکن است تاریخ/زمان های جایگزین ارائه شود.
شما یک پاسخ ایمیلی از FDA برای هر یک از سؤالات خود را ظرف 70 روز پس از دریافت توسط FDA دریافت خواهید کرد. اگر درخواست یک کنفرانس تلفنی داشته باشید، معمولاً پس از دریافت درخواست جلسه قبل از ارسال FDA، حدود 75 ساعت خواهد بود. تیم شما باید یک طرح بحث مفصل برای کنفرانس تلفنی یک ساعته آماده کند. یک عرشه اسلاید برای تسهیل ارتباط بسیار توصیه می شود اما لازم نیست. اگر یک عرشه اسلاید ارائه می کنید، باید آن را قبل از جلسه برای بازبین ایمیل کنید. شما همچنین باید یک کپی از عرشه اسلاید را همراه با صورتجلسه خود ارائه دهید. در ابتدای کنفرانس تلفنی، فردی از تیم شما باید متعهد شود که پیش نویس صورتجلسات جلسه را ظرف 15 روز به FDA ارسال کند. FDA با پذیرش صورتجلسه شما پاسخ خواهد داد، یا نسخه ویرایش شده را ارائه خواهد کرد. همچنین معمول است که یک مکمل پیش از ارسال FDA با پروتکل های دقیق و سوالات جدید برای FDA ارسال کنید.
ارسال شده در: PreSTAR
- محتوای مبتنی بر SEO و توزیع روابط عمومی. امروز تقویت شوید.
- PlatoData.Network Vertical Generative Ai. به خودت قدرت بده دسترسی به اینجا.
- PlatoAiStream. هوش وب 3 دانش تقویت شده دسترسی به اینجا.
- PlatoESG. خودرو / خودروهای الکتریکی، کربن ، CleanTech، انرژی، محیط، خورشیدی، مدیریت پسماند دسترسی به اینجا.
- BlockOffsets. نوسازی مالکیت افست زیست محیطی. دسترسی به اینجا.
- منبع: https://medicaldeviceacademy.com/fda-pre-submission/
