dikirim oleh Rob Packard on Juni 28, 2023
Persyaratan format dan konten untuk pra-pengajuan FDA tidak berubah, tetapi peluncuran FDA PreSTAR telah mengubah segalanya.
[Embedded content]
Apa itu pra-pengajuan FDA?
Pra-pengajuan FDA bertujuan untuk mendapatkan jawaban atas pertanyaan yang Anda miliki tentang pengajuan FDA di masa mendatang. Pra-pengiriman dapat terdiri dari satu dokumen PDF besar atau beberapa dokumen PDF. Di pra-pengiriman Anda, Anda harus memilih salah satu tanggapan email atau tanggapan email dengan telekonferensi. Salah satu keuntungan memilih telekonferensi adalah Anda dapat mengajukan pertanyaan klarifikasi selama satu jam telekonferensi dengan FDA, tetapi Anda bertanggung jawab untuk mengirimkan rancangan risalah rapat ke FDA dalam waktu 15 hari setelah telekonferensi. Jika Anda memilih respons email, Anda tidak perlu memberikan risalah rapat ke FDA. Pada tanggal 5 Juli 2023, kami akan memulai seri webinar pra-pengiriman FDA 4 bagian yang baru. Ini akan menjadi Pelatihan pra-pengajuan FDA terbaik. Jangan sampai ketinggalan.
Apa perbedaan antara pra-pengiriman FDA dan Q-submisi?
Setiap pra-pengiriman FDA adalah Q-submission, tetapi tidak semua Q-submission adalah pra-submisi. Template PreSTAR baru saat ini terbatas pada pra-pengiriman FDA, tetapi template akan diperluas ke jenis Q-sub lainnya nanti. Templat pra-pengajuan FDA (yaitu, PreSTAR) beta versi 0.1 tidak diperlukan untuk tanggapan atas pertanyaan tinjauan interaktif dari FDA. Cukup kirim email ke Lead Reviewer (batas ukuran file adalah 25 MB untuk email).
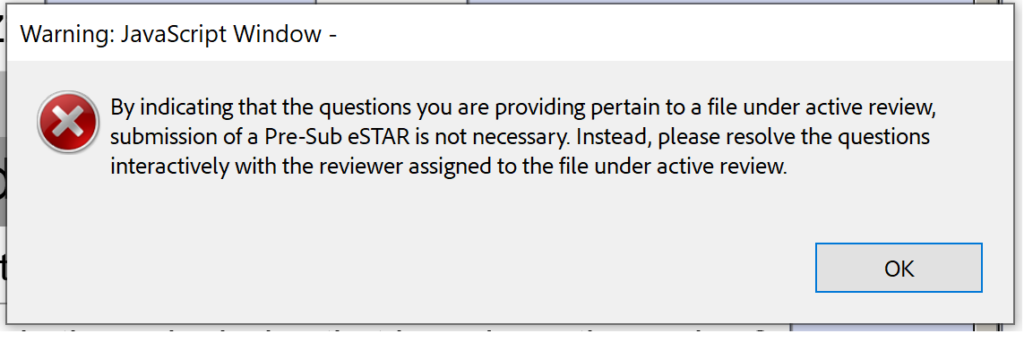
Sayangnya, versi beta 0.1 juga belum siap untuk pertemuan Submission-in-Review (SIR) atau tanggapan terhadap IDE selama tinjauan interaktif.
13 jenis kiriman lain mungkin mendapat manfaat dari kiriman-Q:
- Permintaan Masalah Pengajuan (SIR)
- Pelajari Penentuan Risiko
- Pertemuan Informasi
- Permintaan Penetapan Perangkat Terobosan
- Pertemuan Informasi
- Pertemuan PMA Hari 100
- Rapat Kesepakatan dan Penetapan
- Pengajuan terkait dengan program STeP
- Permintaan klasifikasi aksesori
- Permintaan umpan balik FDA tentang pertanyaan spesifik atau masalah kebijakan lintas sektoral
- Permintaan pengakuan database varian genetik yang dapat diakses publik
- Rapat Kesepakatan Produk Kombinasi (CPAM), dan
- Umpan balik tentang observasi inspeksi FDA 483.
Kami berharap template PreSTAR pada akhirnya akan tersedia untuk permintaan 513(g) di masa mendatang karena telah divalidasi untuk tujuan tersebut.
Berapa nomor pengiriman Q?
Semua kiriman Q diberi nomor dokumen yang dimulai dengan "Q" setelah diterima (yaitu, Qyyxxxx). Format nomor terdiri dari 2 digit (yaitu, "yy") untuk tahun pengajuan (misalnya, "23" untuk 2023) dan 4 digit (yaitu, "xxxx") yang merupakan nomor urut berikut yang ditetapkan oleh FDA untuk tahun kalender itu. Oleh karena itu, pengajuan Q pertama yang diterima oleh FDA pada Januari 2023 adalah Q230001, dan antara 3,500 dan 4,000 pengajuan baru biasanya diterima setiap tahun. Jika perangkat subjek diserahkan dalam Q-submission sebelumnya, nomor dokumen asli digunakan kembali, dan nomor tambahan ditambahkan (yaitu, Qyyxxx/S001, Qyyxxx/S002, dll.). Penomoran Q-submission dijelaskan lebih detail di Panduan FDA 2023.
Apakah FDA mengenakan biaya untuk pengiriman Q?
Pra-pengajuan FDA tidak mengharuskan membayar Biaya Pengguna FDA (yaitu, $0).
Berapa lama waktu pra-pengajuan FDA?
Hari-hari squishing garis waktu hilang. Garis waktunya adalah 70-75 hari-hari kalender. Pada tanggal 5 Oktober 2022, MDUFA V disetujui. Sebagai salah satu target keputusan MDUFA V, FDA ditugaskan untuk mengurangi waktu untuk menjawab pertanyaan pra-sub dalam waktu 70 hari untuk 90% permintaan pra-sub. FDA ditugaskan untuk mencapai tujuan ini pada Maret 2024. Jika mereka berhasil, FDA akan menerima peningkatan 59 jumlah pegawai untuk anggaran mereka pada tahun 2024. Ini kira-kira insentif $19 juta untuk menjawab pertanyaan rapat pra-pengajuan Anda dalam 70 hari. Untuk mencerminkan target keputusan MDUFA V baru ini, FDA memperbarui Panduan Q-Sub dokumen untuk mencerminkan tanggal target 70 hari untuk tanggapan email dan 75 hari untuk rapat telekonferensi. FDA juga memperbarui Portal Kolaborasi Pelanggan (CCP) untuk memfasilitasi pelacakan tenggat waktu pra-pengajuan FDA.
Apa itu PreSTAR FDA?
Di masa lalu, Anda harus membuat dokumen Anda sendiri untuk pra-pengiriman FDA. Beberapa orang membuat satu dokumen PDF besar yang dibagi menjadi beberapa bagian, sementara yang lain membuat dokumen PDF terpisah untuk setiap persyaratan panduan pra-pengiriman FDA. Pada 6 Juni 2023, FDA merilis versi beta (yaitu, versi 0.1) dari template PDF baru (yaitu, FDA PreSTAR). Template PreSTAR baru ini memberikan banyak manfaat bagi FDA:
- setiap perusahaan menggunakan format yang sama,
- template secara otomatis memverifikasi bahwa pra-pengiriman mencakup semua elemen yang diperlukan, dan
- penyertaan elemen opsional akan mendorong perusahaan untuk memberikan lebih banyak detail perangkat daripada yang mungkin mereka sediakan.
PreSTAR juga menguntungkan pengirim:
- Anda tidak akan pernah melupakan elemen yang diperlukan dari pra-pengajuan FDA,
- Anda tidak perlu memvalidasi eCopy FDA, dan
- format dan antarmuka pengguna yang serupa akan melatih Anda untuk menggunakan FDA eSTAR.
Catatan: 1 Oktober 2023 adalah batas waktu penerapan FDA eSTAR.
Apakah harus menggunakan template PreSTAR?
Tidak. Versi PreSTAR 0.1 adalah versi beta dan 100% opsional. Namun, saya lebih menyukainya daripada template saya sendiri. Tim desain Anda masih dapat memiliki dokumen individual untuk panduan pengguna, deskripsi perangkat, dan rencana pengujian. Kami melampirkan dokumen menggunakan tombol yang bertuliskan "Tambah Lampiran" (lihat tangkapan layar di bawah).

Template PreSTAR dibuat oleh Patrick Macatangga, Insinyur Alat & Templat yang bekerja di FDA di Tim Alat dan Templat Siklus Hidup. Untuk membantu mengarahkan pertanyaan tentang template, dia menyarankan:
- Jika Anda memiliki pertanyaan atau umpan balik terkait penggunaan sukarela eSTAR untuk perangkat medis yang diatur oleh CDRH, atau jika Anda memiliki pertanyaan umum tentang perangkat medis, silakan hubungi Divisi Industri dan Edukasi Konsumen (DICE).
- Jika Anda menemukan malfungsi atau kesalahan dalam template eSTAR untuk perangkat medis yang diatur oleh CDRH, silakan hubungi [email dilindungi].
- Jika Anda memiliki pertanyaan tentang 510(k), permintaan De Novo, atau Permintaan Pengajuan Awal untuk perangkat medis yang diatur oleh CDRH, silakan hubungi [email dilindungi].
Bagaimana Anda mengirimkan eCopy?
Anda dapat mengirimkan eCopy FDA pada media elektronik (misalnya USB flash drive) dan mengirimkannya melalui FedEx ke Pusat Dokumen FDA di alamat berikut: Administrasi Makanan dan Obat-obatan, Pusat Perangkat dan Kesehatan Radiologi, Pusat Surat Dokumen, 10903 New Hampshire Ave., Bldg. 66, rm. G609, Musim Semi Perak, MD 20993-0002. Namun, Anda juga dapat mengirimkan eCopy FDA melalui browser web (mis., CCP…lihat bagian selanjutnya tentang cara mengirimkan PreSTAR).
Jika Anda mengirimkan eCopy melalui CCP alih-alih FDA PreSTAR
Bagaimana cara mengirimkan PreSTAR?
Anda memiliki dua opsi untuk pengiriman pra-pengiriman FDA:
- simpan pre-sub pada media elektronik (misalnya USB flash drive) dan kirimkan melalui FedEx ke FDA, dan
- unggah pra-sub ke Portal Kolaborasi Pelanggan FDA (CCP) yang baru.
[Embedded content]
Seperti yang bisa Anda tebak dari video di atas, kami hanya menggunakan opsi 2 untuk pra-pengajuan FDA. Untuk opsi 2, Anda dapat mengunggah eCopy (disimpan sebagai file zip) atau PreSTAR (dalam format PDF asli). Gambar di bawah ini menunjukkan cara melakukannya, tetapi proses pengunggahan biasanya membutuhkan waktu sekitar satu menit–tergantung pada ukuran file dan bandwidth Anda. Kamu bisa daftar untuk akun PKC Anda sendiri dalam hitungan detik.

Bagaimana proses pra-pengajuan?
Mempersiapkan dan mengunggah permintaan pertemuan pra-pengajuan FDA Anda hanyalah langkah pertama dari proses tersebut. Anda akan menerima email otomatis yang mengonfirmasi bahwa pra-pengiriman Anda berhasil diunggah, dan kemudian Anda akan menerima surat otomatis melalui email yang memberi Anda nomor Q-sub yang telah ditetapkan. Anda juga akan menerima email otomatis yang memberi tahu Anda bahwa pra-pengajuan telah diterima, atau peninjau FDA akan menghubungi Anda jika diperlukan perubahan. Peninjau FDA yang ditugaskan biasanya akan menghubungi Anda melalui email dalam tiga minggu pertama untuk menjadwalkan telekonferensi jika Anda memintanya, tetapi tanggal/waktu yang ditawarkan biasanya tidak sesuai dengan ketersediaan tim FDA, dan tanggal/waktu alternatif mungkin ditawarkan.
Anda akan menerima tanggapan email dari FDA untuk setiap pertanyaan Anda dalam waktu 70 hari setelah diterima oleh FDA. Jika Anda meminta telekonferensi, biasanya sekitar 75 setelah menerima permintaan pertemuan pra-pengajuan FDA. Tim Anda perlu menyiapkan rencana diskusi terperinci untuk telekonferensi satu jam. Dek slide sangat disarankan untuk memfasilitasi komunikasi tetapi tidak diperlukan. Jika Anda memberikan dek slide, Anda harus mengirimkannya melalui email ke peninjau sebelum rapat. Anda juga perlu menyediakan salinan dek slide dengan risalah rapat Anda. Di awal telekonferensi, seseorang dari tim Anda harus berkomitmen untuk mengirimkan draf risalah rapat ke FDA dalam waktu 15 hari. FDA akan membalas dengan menerima risalah rapat Anda, atau mereka akan memberikan versi yang telah diedit. Juga umum untuk mengirimkan pra-pengiriman suplemen FDA dengan protokol terperinci dan pertanyaan baru untuk FDA.
Posted in: PraSTAR
- Konten Bertenaga SEO & Distribusi PR. Dapatkan Amplifikasi Hari Ini.
- PlatoData.Jaringan Vertikal Generatif Ai. Berdayakan Diri Anda. Akses Di Sini.
- PlatoAiStream. Intelijen Web3. Pengetahuan Diperkuat. Akses Di Sini.
- PlatoESG. Otomotif / EV, Karbon, teknologi bersih, energi, Lingkungan Hidup, Tenaga surya, Penanganan limbah. Akses Di Sini.
- BlockOffset. Modernisasi Kepemilikan Offset Lingkungan. Akses Di Sini.
- Sumber: https://medicaldeviceacademy.com/fda-pre-submission/
