Glioblastom (GBM) er den dødeligste og mest aggressive formen for hjernekreft. Nesten alle svulster kommer tilbake etter behandling, ettersom overlevende celler forvandles til mer motstandsdyktige former over tid for å motstå ytterligere terapier. For å møte denne utfordringen har forskere ved University of Leeds har designet en ny nanopipette med dobbel tønne og brukt den til å undersøke banene til individuelle levende GBM-celler når de endres som respons på behandling.
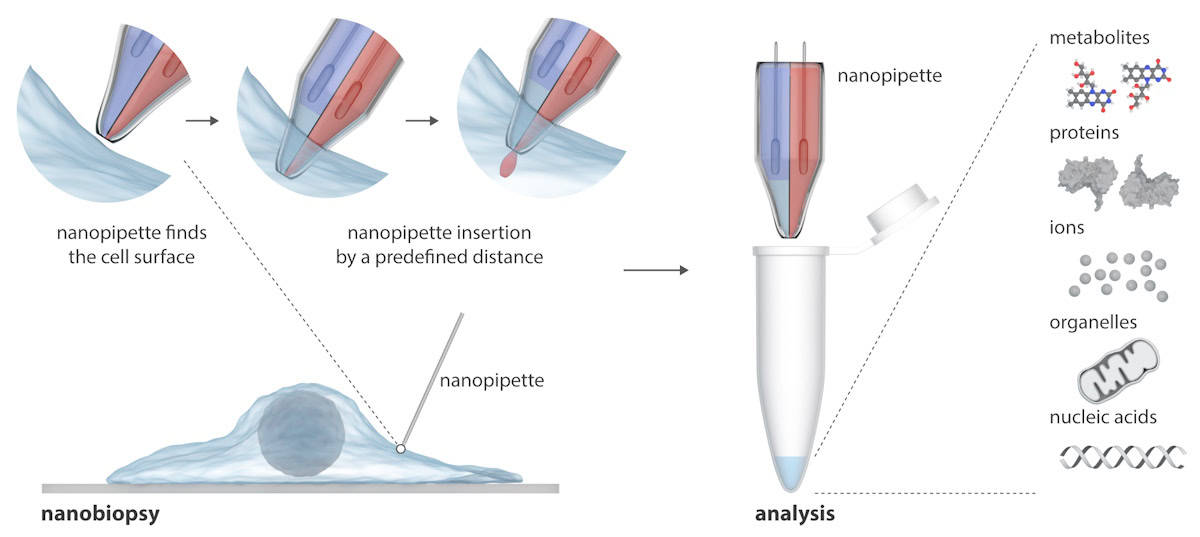
Nanopipetten består av to nanoskopiske nåler som samtidig kan injisere eksogene molekyler inn i og trekke ut cytoplasmaprøver fra en celle. Nanopipetten er integrert i et skanningsionekonduktansmikroskop (SICM) for å utføre nanobiopsier av levende celler i kultur. I motsetning til eksisterende teknikker for å studere enkeltceller, som vanligvis ødelegger cellen, kan nanopipetten ta gjentatte biopsier av en levende celle uten å drepe den, noe som muliggjør longitudinelle studier av en individuell celles oppførsel over tid.
Skriver inn Vitenskap Fremskritt, forklarer forskerne at SICM fungerer ved å måle ionestrømmen mellom en elektrode satt inn i en nanopipette av glass og en referanseelektrode nedsenket i en elektrolytisk løsning som inneholder cellene. Nanobiopsi utføres når en ionestrøm flyter gjennom nanoporen på spissen av nanopipetten etter å ha påført en spenning mellom de to elektrodene. I deres dobbeltønnede nanopipette fungerer ett fat som en elektrokjemisk sprøyte for å utføre cytoplasmatiske ekstraksjoner; den andre inneholder en vandig elektrolyttløsning som gir en stabil ionestrøm for presis posisjonering og nanoinjeksjon før nanobiopsi.
Den halvautomatiske plattformen muliggjør ekstraksjon av femtolitervolumer av cytoplasma og samtidig injeksjon i individuelle celler. Plattformen gir automatisert posisjonering av nanopipetten ved hjelp av tilbakemeldingskontroll (ionestrømmen faller når nanopipetten nærmer seg prøven), mens deteksjon av spesielle strømsignaturer indikerer vellykket membranpenetrasjon av en enkelt celle.
Longitudinelle studier
Som et bevis på plattformens evne, utførte forskerne langsgående nanobiopsi av en GBM-celle (og dens avkom), og profilerte endringer i genuttrykk over 72 timer. De utførte nanobiopsi før terapi, under behandling med strålebehandling og kjemoterapi, og etter behandling.
"Metoden vår er robust og reproduserbar, og tillater membranpenetrasjon og nanoinjeksjon på tvers av forskjellige celletyper med distinkte mekaniske egenskaper," skriver co-hovedetterforskere Lucy Stead og Paolo Actis. "Den gjennomsnittlige suksessraten for nanoinjeksjon er 0.89 ± 0.07. Intracellulært mRNA ekstraheres deretter."
Forskerne undersøkte responsen til GBM-celler på standardbehandlingen av 2 Gy stråling og 30 µM temozolomid. De sporet visuelt individuelle celler og deres avkom i løpet av 72 timer, med 98 % igjen i mikroskopets synsfelt i løpet av denne tidsrammen – en viktig faktor når man sikter på å utføre longitudinell analyse.

På dag 1 tok forskerne en biopsi, injiserte med et fluorescerende fargestoff og avbildet hver celle. På dag 2 fikk halvparten av cellene bestråling og kjemoterapi, mens de andre fungerte som kontroller. Alle celler ble avbildet på dag 2 og 3, og biopsiert og injisert igjen på dag 4.
I celler som gjennomgikk dag-1 nanobiopsier, var overlevelsen lik mellom behandlede og ubehandlede celler, og celledelingshastigheter var sammenlignbare i de to gruppene. Etter 72 timer overlevde 63 % av ubehandlede kontrollceller (ikke biopsierte) sammenlignet med 25 % av de behandlede, biopsierte cellene. Det var ingen forskjell i de påfølgende dødsratene for cellesubtyper på dag 1, uavhengig av behandling. Imidlertid byttet en mye større andel ubehandlede celler subtype over tid, eller produserte avkom med en annen subtype, enn de behandlede cellene.
"Dette tyder på at ubehandlede celler er betydelig mer plastiske i løpet av tre dager enn behandlede celler," skriver forskerne. "Cellefenotypeskårene for parede dag 1 og langsgående prøver avslørte at behandlede celler har en tendens til å opprettholde den samme fenotypen under terapi, mens ubehandlede celler er mer sannsynlig å bytte transkripsjonstilstand over 72 timer, noe som tyder på at behandling enten induserer eller velger høy transkripsjonsstabilitet i denne etablerte GBM-cellelinjen.»
"Dette er et betydelig gjennombrudd," sier Stead. "Det er første gang vi har en teknologi der vi faktisk kan overvåke endringene som skjer etter behandling, i stedet for bare å anta dem. Denne typen teknologi kommer til å gi et lag med forståelse som vi rett og slett aldri har hatt før. Og den nye forståelsen og innsikten vil føre til nye våpen i vårt våpenlager mot alle typer kreft.»

Mekanisk nanokirurgi angriper aggressiv hjernekreft
Teamet er overbevist om at evnen til disse allsidige nanoprobene til å få tilgang til det intracellulære miljøet med minimal forstyrrelse har potensial til å "revolusjonere molekylær diagnostikk, gen- og celleterapier".
"Vårt fremtidige arbeid vil fokusere på å øke gjennomstrømningen av teknologien slik at flere celler kan analyseres," forteller Actis Fysikkens verden. "Vi jobber med å forbedre protokollene for å analysere RNA ekstrahert fra celler, slik at mer biologisk informasjon kan samles inn. Vi er også veldig opptatt av å studere mer avanserte biologiske modeller av hjernekreft basert på pasientavledede celler og organoider."
- SEO-drevet innhold og PR-distribusjon. Bli forsterket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk deg selv. Tilgang her.
- PlatoAiStream. Web3 Intelligence. Kunnskap forsterket. Tilgang her.
- PlatoESG. Karbon, CleanTech, Energi, Miljø, Solenergi, Avfallshåndtering. Tilgang her.
- PlatoHelse. Bioteknologisk og klinisk etterretning. Tilgang her.
- kilde: https://physicsworld.com/a/single-cell-nanobiopsy-explores-how-brain-cancer-cells-adapt-to-resist-treatment/