Postet av Rob Packard on Juni 28, 2023
Formatet og innholdskravene for en forhåndsinnlevering fra FDA har ikke endret seg, men lanseringen av FDA PreSTAR har endret alt.
[Innebygd innhold]
Hva er en forhåndsinnlevering fra FDA?
En forhåndsinnlevering fra FDA har som mål å få svar på spørsmål du har om en fremtidig innlevering fra FDA. Forhåndsinnleveringen kan bestå av ett stort PDF-dokument eller flere PDF-dokumenter. I forhåndsinnleveringen må du velge enten et e-postsvar eller et e-postsvar med en telefonkonferanse. En fordel med å velge en telekonferanse er at du kan stille oppklarende spørsmål under en en times telekonferanse med FDA, men du er ansvarlig for å sende inn utkast til møtereferat til FDA innen 15 dager etter telekonferansen. Hvis du velger et e-postsvar, trenger du ikke gi møtereferater til FDA. 5. juli 2023 starter vi vår nye 4-delte webinarserie fra FDA før innsending. Dette vil være Ultimate FDA trening før innlevering. Ikke gå glipp av det.
Hva er forskjellen mellom en FDA forhåndsinnlevering og en Q-innlevering?
Hver FDA forhåndsinnlevering er en Q-innlevering, men ikke alle Q-innleveringer er forhåndsinnleveringer. Den nye PreSTAR-malen er foreløpig begrenset til en forhåndsinnlevering fra FDA, men malen vil bli utvidet til andre typer Q-subs senere. FDA forhåndsinnleveringsmalen (dvs. PreSTAR) betaversjon 0.1 er unødvendig for svar på interaktive gjennomgangsspørsmål fra FDA. Bare send e-post til hovedanmelderen (filstørrelsesgrensen er 25 MB for e-post).
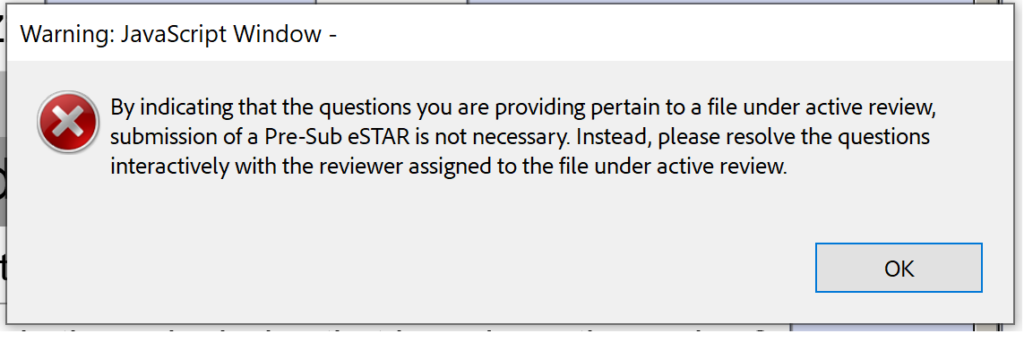
Dessverre er betaversjon 0.1 heller ikke klar for Submission-in-Review (SIR) møter eller svar på IDE under en interaktiv gjennomgang.
13 andre typer innleveringer kan ha nytte av Q-innleveringer:
- Innleveringsforespørsler (SIR)
- Studer risikobestemmelser
- Informasjonsmøter
- Banebrytende forespørsler om enhetsbetegnelse
- Informasjonsmøter
- PMA Dag 100 møter
- Avtale- og fastsettingsmøter
- Innleveringer knyttet til STeP-programmet
- Forespørsler om tilbehørsklassifisering
- Forespørsler om tilbakemelding fra FDA om spesifikke spørsmål eller tverrgående politiske saker
- Forespørsler om anerkjennelse av offentlig tilgjengelige genetiske variantdatabaser
- Kombinasjonsproduktavtalemøter (CPAM), og
- Tilbakemelding på FDA 483 inspeksjonsobservasjoner.
Vi forventer at PreSTAR-malen til slutt vil være tilgjengelig for en 513(g)-forespørsel i fremtiden fordi den allerede var validert for det formålet.
Hva er Q-innleveringsnummeret?
Alle Q-innleveringer blir tildelt et dokumentnummer som begynner med "Q" ved mottak (dvs. Qyyxxxx). Formatet på nummeret består av 2-sifrede (dvs. "yy") for innleveringsåret (f.eks. "23" for 2023) og 4-sifrede (dvs. "xxxx") som er følgende sekvensnummer tildelt av FDA for det kalenderåret. Derfor er den første Q-innleveringen mottatt av FDA i januar 2023 Q230001, og mellom 3,500 og 4,000 nye innleveringer mottas vanligvis hvert år. Hvis emneenheten ble sendt inn i en tidligere Q-innlevering, brukes det originale dokumentnummeret på nytt, og et tilleggsnummer legges til (dvs. Qyyxxx/S001, Qyyxxx/S002, osv.). Q-innleveringsnummerering er forklart mer detaljert i 2023 FDA-veiledning.
Tar FDA betalt for Q-innleveringer?
FDA forhåndsinnleveringer krever ikke betaling av en FDA-brukeravgift (dvs. $0).
Hvor lang tid tar en forhåndsinnlevering fra FDA?
Dagene med squishing tidslinjer er borte. Tidslinjen er 70-75 kalender dager. 5. oktober 2022, MDUFA V ble godkjent. Som et av MDUFA V-avgjørelsesmålene har FDA i oppgave å redusere tidslinjen for å svare på spørsmål før undersøking innen 70 dager for 90 % av forespørsler før undersøking. FDA har i oppgave å nå dette målet innen mars 2024. Hvis de lykkes, vil FDA motta en økning på 59 ansatte til budsjettet deres i 2024. Dette er et insentiv på omtrent 19 millioner dollar for å svare på spørsmålene dine før innlevering av møte innen 70 dager. For å gjenspeile disse nye MDUFA V-beslutningsmålene, oppdaterte FDA Q-Sub veiledning dokumentet for å gjenspeile måldatoen på 70 dager for e-postsvar og 75 dager for telefonkonferansemøter. FDA oppdaterte også Customer Collaboration Portal (CCP) for å lette sporing av FDA-frister før innsending.
Hva er en FDA PreSTAR?
Tidligere måtte du lage dine egne dokument(er) for en forhåndsinnlevering fra FDA. Noen mennesker lager ett stort PDF-dokument delt inn i seksjoner, mens andre lager separate PDF-dokumenter for hvert krav i FDA-veiledningen før innsending. 6. juni 2023 ga FDA ut en betaversjon (dvs. versjon 0.1) av en ny PDF-mal (dvs. FDA PreSTAR). Denne nye PreSTAR-malen gir flere fordeler til FDA:
- hvert selskap bruker samme format,
- malen verifiserer automatisk at forhåndsinnleveringen inkluderer alle nødvendige elementer, og
- inkludering av valgfrie elementer vil oppmuntre bedrifter til å oppgi flere enhetsdetaljer enn de ellers kunne oppgi.
PreSTAR kommer også innsendere til gode:
- du vil aldri glemme de nødvendige elementene i FDA forhåndsinnlevering,
- du trenger aldri å validere en FDA eCopy, og
- det lignende formatet og brukergrensesnittet vil lære deg å bruke FDA eSTAR.
Merk: 1. oktober 2023 er fristen for implementering av FDA eSTAR.
Må du bruke PreSTAR-malen?
Nei. PreSTAR versjon 0.1 er en betaversjon og 100 % valgfri. Men jeg liker det bedre enn mine egne maler. Designteamet ditt kan fortsatt ha individuelle dokumenter for brukermanualen, enhetsbeskrivelsen og testplanen. Vi legger ved dokumentet ved å bruke knappen som sier "Legg til vedlegg" (se skjermbilde nedenfor).

PreSTAR-malen ble bygget av Patrick Macatangga, en verktøy- og malingeniør som jobber ved FDA i Lifecycle Tools and Templates-teamet. For å hjelpe med hvor du kan stille spørsmål om malen, foreslo han:
- Hvis du har spørsmål eller tilbakemeldinger angående frivillig bruk av eSTAR for medisinsk utstyr regulert av CDRH, eller hvis du har generelle spørsmål om medisinsk utstyr, vennligst kontakt Divisjon for industri og forbrukerutdanning (DICE).
- Hvis du finner noen funksjonsfeil eller feil i eSTAR-malen for medisinsk utstyr regulert av CDRH, vennligst kontakt [e-postbeskyttet].
- Hvis du har spørsmål angående 510(k)s, De Novo-forespørsler eller tidlige innleveringsforespørsler for medisinsk utstyr regulert av CDRH, vennligst kontakt [e-postbeskyttet].
Hvordan sender du inn en eCopy?
Du kan sende inn en FDA eCopy på elektroniske medier (f.eks. USB-flash-stasjon) og sende den via FedEx til FDA Document Center på følgende adresse: Food and Drug Administration, Center for Devices and Radiological Health, Document Mail Center, 10903 New Hampshire Ave., Bldg. 66, rm. G609, Silver Spring, MD 20993-0002. Du kan imidlertid også sende inn en FDA eCopy via en nettleser (dvs. CCP ... se neste avsnitt om hvordan du sender inn en PreSTAR).
Hvis du sender inn en eCopy gjennom CCP i stedet for en FDA PreSTAR
Hvordan sender du inn en PreSTAR?
Du har to alternativer for levering av en forhåndsinnlevering fra FDA:
- lagre pre-sub på elektroniske medier (f.eks. USB flash-stasjon) og send den via FedEx til FDA, og
- last opp pre-sub til den nye FDA Customer Collaboration Portal (CCP).
[Innebygd innhold]
Som du kan gjette fra videoen ovenfor, bruker vi bare alternativ 2 for forhåndsinnleveringer fra FDA. For alternativ 2 kan du laste opp en eCopy (lagret som en zip-fil) eller en PreSTAR (i det opprinnelige PDF-formatet). Bildet nedenfor viser deg hvordan dette gjøres, men opplastingsprosessen tar vanligvis omtrent ett minutt – avhengig av filstørrelse og båndbredde. Du kan registrere for din egen CCP-konto på sekunder.

Hva er prosessen med forhåndsinnlevering?
Å forberede og laste opp møteforespørselen fra FDA før innlevering er bare det første trinnet i prosessen. Du vil motta en automatisk e-post som bekrefter at forhåndsinnleveringen din ble lastet opp, og deretter vil du motta et automatisk brev via e-post som gir deg Q-sub-nummeret som ble tildelt. Du vil også motta en automatisk e-post som varsler deg om at forhåndsinnleveringen ble akseptert, eller FDA-kontrolløren vil kontakte deg hvis endringer er nødvendig. FDA-kontrolløren som er tildelt vil vanligvis kontakte deg på e-post innen de første tre ukene for å planlegge en telefonkonferanse hvis du ba om en, men datoen/klokkeslettet som tilbys samsvarer vanligvis ikke med tilgjengeligheten til FDA-teamet, og alternative datoer/klokkeslett kan bli tilbudt.
Du vil motta et e-postsvar fra FDA for hvert av spørsmålene dine innen 70 dager etter mottak av FDA. Hvis du ber om en telefonkonferanse, vil det vanligvis være rundt 75 etter mottak av FDA-møteforespørselen før innlevering. Teamet ditt må utarbeide en detaljert diskusjonsplan for en times telefonkonferanse. En glidebane er sterkt anbefalt for å lette kommunikasjonen, men er ikke nødvendig. Hvis du leverer en lysbildestokk, bør du sende den på e-post til anmelderen i forkant av møtet. Du må også levere en kopi av lysbildestokken sammen med møteprotokollene dine. Ved begynnelsen av telefonkonferansen må noen fra teamet ditt forplikte seg til å sende utkast til møtereferat til FDA innen 15 dager. FDA vil svare med aksept av møteprotokollene dine, eller de vil gi en redigert versjon. Det er også vanlig å sende inn en supplement FDA forhåndsinnlevering med detaljerte protokoller og nye spørsmål til FDA.
Postet i: PreSTAR
- SEO-drevet innhold og PR-distribusjon. Bli forsterket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk deg selv. Tilgang her.
- PlatoAiStream. Web3 Intelligence. Kunnskap forsterket. Tilgang her.
- PlatoESG. Bil / elbiler, Karbon, CleanTech, Energi, Miljø, Solenergi, Avfallshåndtering. Tilgang her.
- BlockOffsets. Modernisering av eierskap for miljøkompensasjon. Tilgang her.
- kilde: https://medicaldeviceacademy.com/fda-pre-submission/
