Avtor Rob Packard on Junij 28, 2023
Zahteve glede formata in vsebine za predhodno oddajo FDA se niso spremenile, vendar je lansiranje FDA PreSTAR spremenilo vse.
[Vgrajeni vsebina]
Kaj je predoddaja FDA?
Namen predoddaje FDA je pridobiti odgovore na vaša vprašanja o prihodnji predložitvi FDA. Predoddaja je lahko sestavljena iz enega velikega dokumenta PDF ali več dokumentov PDF. V predoddaji morate izbrati e-poštni odgovor ali e-poštni odgovor s telekonferenco. Ena od prednosti izbire telekonference je, da lahko med enourno telekonferenco z FDA postavljate pojasnilna vprašanja, vendar ste odgovorni za predložitev osnutka zapisnika sestanka FDA v 15 dneh po telekonferenci. Če izberete odgovor po e-pošti, vam FDA ni treba posredovati zapisnika sestanka. 5. julija 2023 začenjamo našo novo 4-delno serijo spletnih seminarjev FDA pred oddajo. To bo Vrhunsko usposabljanje FDA pred oddajo. Ne zamudi.
Kakšna je razlika med predhodno predložitvijo FDA in Q-predložitvijo?
Vsaka predoddaja FDA je Q-predložitev, vendar niso vse Q-predložitve predoddane. Nova predloga PreSTAR je trenutno omejena na predhodno oddajo FDA, vendar bo predloga pozneje razširjena na druge vrste Q-sub. Predloga FDA pred oddajo (tj. PreSTAR) različica beta 0.1 ni potrebna za odgovore na vprašanja FDA za interaktivni pregled. Samo pošljite e-pošto vodilnemu ocenjevalcu (omejitev velikosti datoteke je 25 MB za e-pošto).
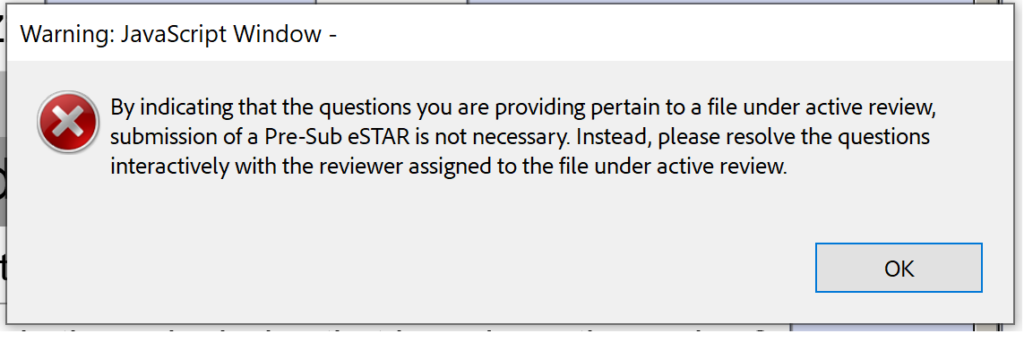
Na žalost različica beta 0.1 prav tako ni pripravljena za sestanke Submission-in-Review (SIR) ali odzive na IDE med interaktivnim pregledom.
13 drugim vrstam predložitev bi lahko koristilo Q-predložitve:
- Zahteve za oddajo težav (SIR)
- Ugotovitve tveganja študije
- Informativni sestanki
- Zahteve za imenovanje prelomnih naprav
- Informativni sestanki
- PMA Day 100 srečanj
- Sestanki za dogovor in določitev
- Predložitve, povezane s programom STeP
- Zahteve za klasifikacijo dodatkov
- Zahteve za povratne informacije FDA o posebnih vprašanjih ali medsektorskih političnih zadevah
- Zahteve za priznanje javno dostopnih podatkovnih zbirk genetskih variant
- Sestanki o dogovoru o kombiniranih izdelkih (CPAM) in
- Povratne informacije o inšpekcijskih opažanjih FDA 483.
Pričakujemo, da bo predloga PreSTAR sčasoma na voljo za zahtevo 513(g) v prihodnosti, ker je bila že potrjena za ta namen.
Kakšna je številka oddaje Q?
Vsem Q-oddajam se ob prejemu dodeli številka dokumenta, ki se začne z »Q« (tj. Qyyxxxx). Oblika zapisa številke je sestavljena iz 2-mestnega (tj. »yy«) za leto oddaje (npr. »23« za 2023) in 4-mestnega (tj. »xxxx«), ki je naslednja zaporedna številka, ki jo dodeli FDA za tisto koledarsko leto. Zato je prva Q-predložitev, ki jo je FDA prejela januarja 2023, Q230001, vsako leto pa se običajno prejme med 3,500 in 4,000 novih vlog. Če je bila predmetna naprava predložena v prejšnji oddaji Q, se originalna številka dokumenta ponovno uporabi in doda se dodatna številka (tj. Qyyxxx/S001, Qyyxxx/S002 itd.). Oštevilčevanje oddaje Q je podrobneje razloženo v 2023 Smernice FDA.
Ali FDA zaračuna Q-predložitve?
Za predoddaje FDA ni treba plačati uporabnine FDA (tj. 0 USD).
Kako dolgo traja predoddaja FDA?
Dnevi stiskanja časovnic so minili. Časovnica je 70-75 koledarskih dni. 5. oktobra 2022 je MDUFA V je bil odobren. Kot eden od ciljev odločitve MDUFA V je FDA zadolžena, da skrajša časovni okvir za odgovore na vprašanja pred podpisom v 70 dneh za 90 % zahtev pred podpisom. FDA ima nalogo doseči ta cilj do marca 2024. Če bodo uspešni, bo FDA v letu 59 prejela povečanje za 2024 zaposlenih v svojem proračunu. To je približno 19 milijonov USD spodbude, da odgovorite na vaša vprašanja pred sestankom v 70. dnevi. Da bi odražala te nove odločitvene cilje MDUFA V, je FDA posodobila Q-Sub vodenje dokument, ki odraža ciljni datum 70 dni za odgovor po elektronski pošti in 75 dni za telekonferenčne sestanke. FDA je posodobila tudi portal za sodelovanje s strankami (CCP), da bi olajšala sledenje rokom FDA pred oddajo.
Kaj je FDA PreSTAR?
V preteklosti ste morali ustvariti lastne dokumente za predhodno oddajo FDA. Nekateri ustvarijo en velik dokument PDF, razdeljen na odseke, medtem ko drugi ustvarijo ločene dokumente PDF za vsako zahtevo smernic FDA pred oddajo. 6. junija 2023 je FDA izdala različico beta (tj. različica 0.1) nove predloge PDF (tj. FDA PreSTAR). Ta nova predloga PreSTAR FDA zagotavlja številne prednosti:
- vsako podjetje uporablja isti format,
- predloga samodejno preveri, ali predoddaja vključuje vse zahtevane elemente, in
- vključitev neobveznih elementov bo spodbudila podjetja, da zagotovijo več podrobnosti o napravah, kot bi jih sicer.
PreSTAR koristi tudi predlagateljem:
- nikoli ne boste pozabili zahtevanih elementov predoddaje FDA,
- nikoli vam ni treba potrditi FDA eCopy in
- podoben format in uporabniški vmesnik vas bosta naučila uporabljati FDA eSTAR.
Opomba: 1. oktober 2023 je rok za implementacijo FDA eSTAR.
Ali morate uporabiti predlogo PreSTAR?
Ne. Različica PreSTAR 0.1 je različica beta in 100 % neobvezna. Vendar mi je bolj všeč kot lastne predloge. Vaša oblikovalska skupina ima lahko še vedno posamezne dokumente za uporabniški priročnik, opis naprave in načrt testiranja. Dokument priložimo z gumbom »Dodaj prilogo« (glejte posnetek zaslona spodaj).

Predlogo PreSTAR je izdelal Patrick Macatangga, inženir za orodja in predloge, ki dela pri FDA v ekipi za orodja in predloge življenjskega cikla. Za pomoč pri tem, kam usmeriti vprašanja o predlogi, je predlagal:
- Če imate vprašanja ali povratne informacije v zvezi s prostovoljno uporabo eSTAR za medicinske pripomočke, ki jih ureja CDRH, ali če imate splošna vprašanja o medicinskih pripomočkih, se obrnite na Oddelek za industrijo in izobraževanje potrošnikov (DICE).
- Če najdete kakršne koli okvare ali napake v predlogi eSTAR za medicinske pripomočke, ki jih ureja CDRH, se obrnite na [e-pošta zaščitena].
- Če imate vprašanja glede 510(k)s, zahtevkov De Novo ali zahtevkov za zgodnjo oddajo za medicinske pripomočke, ki jih ureja CDRH, se obrnite na [e-pošta zaščitena].
Kako oddate eCopy?
FDA eCopy lahko oddate na elektronskem mediju (npr. ključek USB) in ga pošljete prek FedExa v dokumentni center FDA na naslednji naslov: Uprava za hrano in zdravila, Center za naprave in radiološko zdravje, poštni center za dokumente, 10903 New Hampshire Ave., Bldg. 66, rm. G609, Silver Spring, MD 20993-0002. Vendar pa lahko FDA eCopy predložite tudi prek spletnega brskalnika (tj. CCP … glejte naslednji razdelek o tem, kako predložiti PreSTAR).
Če pošiljate eCopy prek CCP namesto FDA PreSTAR
Kako oddate PreSTAR?
Imate dve možnosti za dostavo predoddaje FDA:
- shranite predpodpis na elektronski medij (npr. bliskovni pogon USB) in ga prek FedExa pošljite FDA ter
- pre-sub naložite na novi FDA portal za sodelovanje s strankami (CCP).
[Vgrajeni vsebina]
Kot lahko uganete iz zgornjega videa, uporabljamo samo možnost 2 za predoddaje FDA. Za možnost 2 lahko naložite eCopy (shranjeno kot datoteko zip) ali PreSTAR (v izvornem formatu PDF). Spodnja slika prikazuje, kako se to naredi, vendar postopek nalaganja običajno traja približno eno minuto – odvisno od velikosti datoteke in pasovne širine. Ti lahko Registracija za svoj račun CCP v nekaj sekundah.

Kakšen je postopek pred oddajo?
Priprava in nalaganje vaše zahteve za srečanje pred oddajo FDA je le prvi korak postopka. Prejeli boste samodejno e-poštno sporočilo, ki potrjuje, da je bila vaša predoddaja uspešno naložena, nato pa boste po e-pošti prejeli samodejno pismo, ki vam bo dalo dodeljeno številko Q-sub. Prav tako boste prejeli samodejno e-poštno sporočilo z obvestilom, da je bila predoddaja sprejeta, ali pa vas bo ocenjevalec FDA kontaktiral, če bodo potrebne spremembe. Dodeljeni ocenjevalec FDA vas bo običajno kontaktiral po e-pošti v prvih treh tednih, da načrtuje telekonferenco, če ste jo zahtevali, vendar se ponujeni datum/ura običajno ne ujema z razpoložljivostjo ekipe FDA, zato so lahko ponujeni nadomestni datumi/ure.
Od FDA boste prejeli e-poštni odgovor za vsako vaše vprašanje v 70 dneh po prejemu s strani FDA. Če ste zahtevali telekonferenco, bi to običajno minilo okoli 75 po prejemu zahteve za sestanek FDA pred oddajo. Vaša ekipa mora pripraviti podroben načrt razprave za enourno telekonferenco. Diapozitiv je zelo priporočljiv za lažjo komunikacijo, vendar ni obvezen. Če zagotovite komplet diapozitivov, ga po e-pošti ocenjevalcu pred sestankom. Zagotoviti boste morali tudi kopijo diapozitivov z zapisnikom sestanka. Na začetku telekonference se mora nekdo iz vaše ekipe zavezati, da bo FDA v 15 dneh predložil osnutek zapisnika sestanka. FDA bo odgovorila s sprejetjem zapisnika vašega sestanka ali pa bo zagotovila urejeno različico. Prav tako je običajno predložiti dodatek FDA pred oddajo s podrobnimi protokoli in novimi vprašanji za FDA.
Objavljeno v: PreSTAR
- Distribucija vsebine in PR s pomočjo SEO. Okrepite se še danes.
- PlatoData.Network Vertical Generative Ai. Opolnomočite se. Dostopite tukaj.
- PlatoAiStream. Web3 Intelligence. Razširjeno znanje. Dostopite tukaj.
- PlatoESG. Avtomobili/EV, Ogljik, CleanTech, Energija, Okolje, sončna energija, Ravnanje z odpadki. Dostopite tukaj.
- BlockOffsets. Posodobitev okoljskega offset lastništva. Dostopite tukaj.
- vir: https://medicaldeviceacademy.com/fda-pre-submission/
