Опубліковано Роб Паккард on 28 Червня, 2023.
Вимоги до формату та вмісту для попереднього подання FDA не змінилися, але запуск FDA PreSTAR все змінив.
[Вбудоване вміст]
Що таке попереднє подання FDA?
An FDA pre-submission aims to get answers to questions you have about a future FDA submission. The pre-submission may consist of one large PDF document or multiple PDF documents. In your pre-submission, you must select either an email response or an email response with a teleconference. One advantage of choosing a teleconference is that you can ask clarifying questions during a one-hour teleconference with the FDA, but you are responsible for submitting draft meeting minutes to the FDA within 15 days of the teleconference. If you select an email response, you do not need to provide meeting minutes to the FDA. On July 5, 2023, we are kicking off our new 4-part FDA pre-submission webinar series. This will be the Ultimate FDA pre-submission training. Do not miss it.
Яка різниця між попереднім поданням FDA та Q-поданням?
Кожне попереднє подання FDA є Q-поданням, але не всі Q-подання є попередніми поданнями. Новий шаблон PreSTAR наразі обмежується попередньою подачею FDA, але пізніше шаблон буде розширено для інших типів Q-sub. Шаблон попереднього подання FDA (тобто PreSTAR) бета-версія 0.1 не потрібен для відповідей на запитання інтерактивного огляду від FDA. Просто надішліть електронного листа провідному рецензенту (обмеження розміру файлу для електронної пошти – 25 МБ).
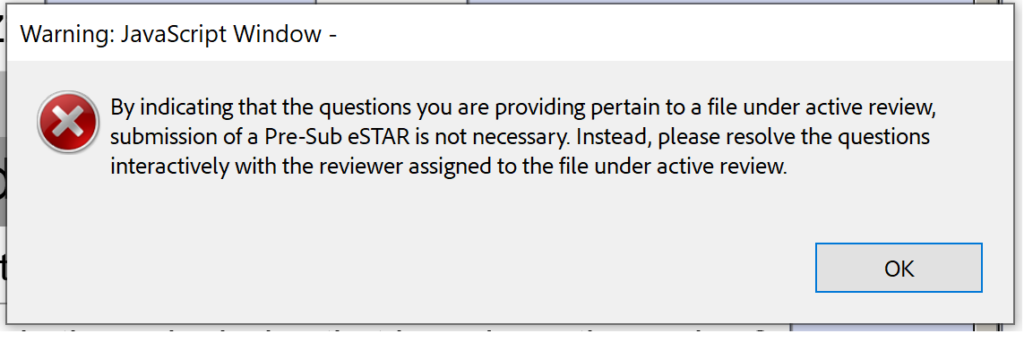
На жаль, бета-версія 0.1 також не готова для зустрічей Submission-in-Review (SIR) або відповідей на IDE під час інтерактивного перегляду.
13 інших типів подання можуть отримати користь від Q-подання:
- Запити на подання проблем (SIR)
- Визначення ризику дослідження
- Інформаційні зустрічі
- Запити на позначення проривних пристроїв
- Інформаційні зустрічі
- PMA Day 100 зустрічей
- Зустрічі за домовленістю та визначенням
- Подання, пов’язані з програмою STeP
- Запити на класифікацію аксесуарів
- Запити щодо відгуків FDA щодо конкретних питань або наскрізних питань політики
- Запити на визнання загальнодоступних баз даних генетичних варіантів
- Зустрічі щодо угоди про комбінований продукт (CPAM) і
- Відгук про спостереження FDA 483 інспекції.
Ми очікуємо, що в майбутньому шаблон PreSTAR стане доступним для запиту 513(g), оскільки його вже перевірено для цієї мети.
Що таке номер Q-подання?
Усім Q-поданням після отримання присвоюється номер документа, який починається з «Q» (тобто Qyyxxxx). Формат номера складається з 2 цифр (тобто «yy») року подання (наприклад, «23» для 2023) і 4 цифр (тобто «xxxx»), які є наступним порядковим номером, присвоєним FDA за цей календарний рік. Таким чином, перше Q-подання, отримане FDA у січні 2023 року, – це Q230001, і щороку зазвичай надходить від 3,500 до 4,000 нових повідомлень. Якщо пристрій, що розглядається, було надано в попередній Q-передачі, вихідний номер документа використовується повторно та додається додатковий номер (тобто Qyyxxx/S001, Qyyxxx/S002 тощо). Нумерація Q-подання більш детально описана в Керівництво FDA 2023.
Чи стягує FDA плату за Q-подання?
Попереднє подання FDA не вимагає сплати збору користувача FDA (тобто 0 доларів США).
Скільки часу займає попереднє подання FDA?
Часи хлюпання часових рамок минули. Хронологія є 70-75 календарних днів. 5 жовтня 2022 р. МДУФА В було затверджено. Як одна з цілей рішення MDUFA V, FDA має завдання скоротити терміни для відповідей на попередні запитання протягом 70 днів для 90% попередніх запитів. FDA має завдання досягти цієї мети до березня 2024 року. Якщо вони досягнуть успіху, FDA отримає збільшення на 59 штатів до свого бюджету в 2024 році. Це приблизно 19 мільйонів доларів США, щоб відповісти на ваші запитання перед зустріччю протягом 70 років. днів. Щоб відобразити ці нові цілі рішення MDUFA V, FDA оновило Керівництво Q-Sub документ із зазначенням цільової дати 70 днів для відповіді електронною поштою та 75 днів для телеконференцій. FDA також оновило портал співпраці з клієнтами (CCP), щоб полегшити відстеження термінів попереднього подання FDA.
Що таке FDA PreSTAR?
Раніше вам доводилося створювати власні документи для попереднього подання FDA. Деякі люди створюють один великий PDF-документ, розділений на розділи, тоді як інші створюють окремі PDF-документи для кожної вимоги вказівок FDA перед поданням. 6 червня 2023 року FDA випустило бета-версію (тобто версія 0.1) нового шаблону PDF (наприклад, FDA PreSTAR). Цей новий шаблон PreSTAR надає багато переваг FDA:
- кожна компанія використовує той самий формат,
- шаблон автоматично перевіряє, що попереднє подання містить усі необхідні елементи, а також
- включення додаткових елементів спонукатиме компанії надавати більше інформації про пристрій, ніж вони могли б надати іншим способом.
PreSTAR також приносить переваги заявникам:
- ви ніколи не забудете обов'язкові елементи попереднього подання FDA,
- вам ніколи не доведеться перевіряти FDA eCopy, і
- Подібний формат і інтерфейс користувача навчать вас використовувати FDA eSTAR.
Примітка: 1 жовтня 2023 року є крайнім терміном впровадження FDA eSTAR.
Чи потрібно використовувати шаблон PreSTAR?
ні. PreSTAR версії 0.1 є бета-версією та є на 100% необов’язковою. Однак мені це подобається більше, ніж мої власні шаблони. Ваша команда розробників все ще може мати окремі документи для посібника користувача, опису пристрою та плану тестування. Ми прикріплюємо документ за допомогою кнопки «Додати вкладення» (див. знімок екрана нижче).

Шаблон PreSTAR створив Патрік Макатангга, інженер із інструментів і шаблонів, який працює в FDA у групі інструментів і шаблонів життєвого циклу. Щоб допомогти визначити, куди направляти запитання щодо шаблону, він запропонував:
- Якщо у вас є запитання чи відгуки щодо добровільного використання eSTAR для медичних пристроїв, які регулюються CDRH, або якщо у вас є загальні запитання щодо медичних пристроїв, зверніться до Відділ промислової та споживчої освіти (DICE).
- Якщо ви виявите будь-які несправності або помилки в шаблоні eSTAR для медичних пристроїв, які регулюються CDRH, будь ласка, зв’яжіться з [захищено електронною поштою].
- Якщо у вас виникли запитання щодо 510(k)s, запитів De Novo або запитів на ранню подачу медичних пристроїв, які регулюються CDRH, зв’яжіться з [захищено електронною поштою].
Як подати eCopy?
Ви можете подати FDA eCopy на електронному носії (наприклад, флеш-пам’ять USB) і надіслати його через FedEx до Центру документів FDA за такою адресою: Управління з продовольства і медикаментів, Центр пристроїв і радіологічного здоров’я, Центр пошти документів, 10903 New Hampshire Ave., Bldg. 66, пм. G609, Silver Spring, MD 20993-0002. Однак ви також можете подати FDA eCopy через веб-браузер (тобто CCP… див. наступний розділ про те, як подати PreSTAR).
Якщо ви подаєте eCopy через CCP замість FDA PreSTAR
Як подати PreSTAR?
У вас є два варіанти попереднього подання FDA:
- збережіть попередній запис на електронному носії (наприклад, флеш-пам’ять USB) і надішліть його через FedEx до FDA, і
- завантажте попередній підпис на новий портал співпраці з клієнтами FDA (CCP).
[Вбудоване вміст]
Як ви можете здогадатися з відео вище, ми використовуємо лише варіант 2 для попереднього подання FDA. Для варіанту 2 ви можете завантажити eCopy (збережений як zip-файл) або PreSTAR (у рідному форматі PDF). На зображенні нижче показано, як це робиться, але процес завантаження зазвичай займає близько однієї хвилини — залежно від розміру файлу та пропускної здатності. Ти можеш реєструвати для вашого власного облікового запису CCP за лічені секунди.

Що таке процес попереднього подання?
Підготовка та завантаження вашого запиту на нараду перед поданням FDA є лише першим кроком процесу. Ви отримаєте автоматичний електронний лист із підтвердженням того, що ваше попереднє надсилання успішно завантажено, а потім ви отримаєте електронним листом автоматичний лист із присвоєним номером Q-sub. Ви також отримаєте автоматичний електронний лист зі сповіщенням про те, що попередню заявку прийнято, або рецензент FDA зв’яжеться з вами, якщо знадобляться зміни. Призначений рецензент FDA зазвичай зв’яжеться з вами електронною поштою протягом перших трьох тижнів, щоб запланувати телеконференцію, якщо ви її замовили, але запропоновані дата/час зазвичай не збігаються з наявністю команди FDA, тому можуть бути запропоновані альтернативні дати/час.
Ви отримаєте відповідь електронною поштою від FDA на кожне ваше запитання протягом 70 днів після отримання FDA. Якщо ви запросили телеконференцію, зазвичай це буде приблизно через 75 годин після отримання запиту на нараду перед поданням FDA. Ваша команда має підготувати детальний план обговорення для одногодинної телеконференції. Для полегшення спілкування настійно рекомендується використовувати слайд-деку, але вона не обов’язкова. Якщо ви надаєте слайд-колоду, ви повинні надіслати її електронною поштою рецензенту перед зустріччю. Вам також потрібно буде надати копію слайдів із протоколом зустрічі. На початку телеконференції хтось із вашої команди повинен взяти на себе зобов’язання подати проект протоколу зустрічі до FDA протягом 15 днів. У відповідь FDA прийме протокол вашої зустрічі або надасть відредаговану версію. Також прийнято подавати додаткову попередню заявку FDA з детальними протоколами та новими запитаннями для FDA.
Опубліковано в: PreSTAR
- Розповсюдження контенту та PR на основі SEO. Отримайте посилення сьогодні.
- PlatoData.Network Vertical Generative Ai. Додайте собі сили. Доступ тут.
- PlatoAiStream. Web3 Intelligence. Розширення знань. Доступ тут.
- ПлатонЕСГ. Автомобільні / електромобілі, вуглець, CleanTech, Енергія, Навколишнє середовище, Сонячна, Поводження з відходами. Доступ тут.
- BlockOffsets. Модернізація екологічної компенсаційної власності. Доступ тут.
- джерело: https://medicaldeviceacademy.com/fda-pre-submission/
