کی طرف سے پوسٹ روب پیکارڈ on جون 28، 2023
FDA پری جمع کرانے کے لیے فارمیٹ اور مواد کے تقاضے تبدیل نہیں ہوئے ہیں، لیکن FDA PreSTAR کے آغاز نے سب کچھ بدل دیا ہے۔
[سرایت مواد]
FDA پری جمع کروانا کیا ہے؟
An FDA pre-submission aims to get answers to questions you have about a future FDA submission. The pre-submission may consist of one large PDF document or multiple PDF documents. In your pre-submission, you must select either an email response or an email response with a teleconference. One advantage of choosing a teleconference is that you can ask clarifying questions during a one-hour teleconference with the FDA, but you are responsible for submitting draft meeting minutes to the FDA within 15 days of the teleconference. If you select an email response, you do not need to provide meeting minutes to the FDA. On July 5, 2023, we are kicking off our new 4-part FDA pre-submission webinar series. This will be the Ultimate FDA pre-submission training. Do not miss it.
FDA پری جمع کرانے اور Q-جمع کرانے میں کیا فرق ہے؟
ہر ایف ڈی اے کی پیشگی جمع آوری ایک Q-سبمیشن ہے، لیکن تمام Q-سبمیشنز پہلے سے جمع نہیں ہوتی ہیں۔ نیا PreSTAR ٹیمپلیٹ فی الحال FDA پری جمع کرانے تک محدود ہے، لیکن ٹیمپلیٹ کو بعد میں Q-subs کی دیگر اقسام تک بڑھا دیا جائے گا۔ FDA پری جمع کرانے والی ٹیمپلیٹ (یعنی، PreSTAR) بیٹا ورژن 0.1 FDA کی طرف سے انٹرایکٹو جائزہ سوالات کے جوابات کے لیے غیر ضروری ہے۔ صرف لیڈ ریویو کو ای میل کریں (ای میل کے لیے فائل کے سائز کی حد 25 ایم بی ہے)۔
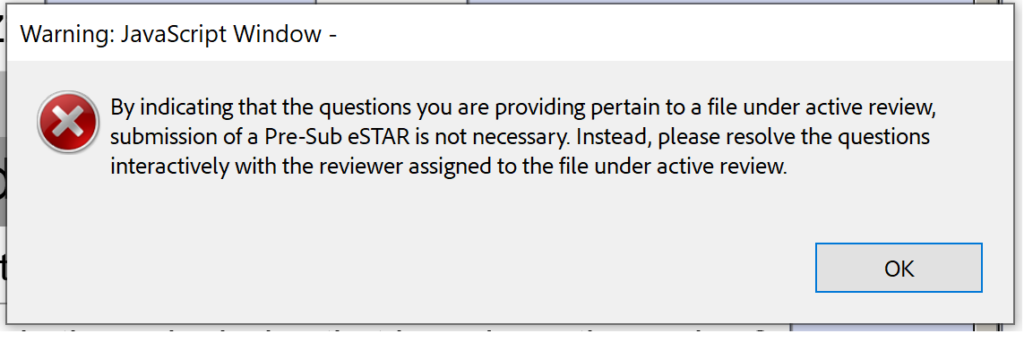
بدقسمتی سے، بیٹا ورژن 0.1 ایک انٹرایکٹو جائزہ کے دوران سبمشن ان ریویو (SIR) میٹنگز یا IDE کے جوابات کے لیے بھی تیار نہیں ہے۔
13 دیگر قسم کی گذارشات Q- گذارشات سے فائدہ اٹھا سکتی ہیں:
- جمع کرانے کے معاملے کی درخواستیں (SIRs)
- خطرے کے تعین کا مطالعہ کریں۔
- معلوماتی میٹنگز
- بریک تھرو ڈیوائس عہدہ کی درخواستیں۔
- معلوماتی میٹنگز
- پی ایم اے کے دن 100 اجلاس
- معاہدے اور عزم کی میٹنگز
- STeP پروگرام سے وابستہ گذارشات
- لوازمات کی درجہ بندی کی درخواستیں۔
- مخصوص سوالات یا کراس کٹنگ پالیسی معاملات پر FDA کے تاثرات کی درخواستیں۔
- عوامی طور پر قابل رسائی جینیاتی مختلف ڈیٹا بیس کی شناخت کے لیے درخواستیں۔
- امتزاج مصنوعات کے معاہدے کی میٹنگز (CPAM)، اور
- FDA 483 معائنہ کے مشاہدات پر تاثرات۔
ہم توقع کرتے ہیں کہ PreSTAR ٹیمپلیٹ بالآخر مستقبل میں 513(g) درخواست کے لیے دستیاب ہو گا کیونکہ اس مقصد کے لیے اس کی توثیق ہو چکی تھی۔
Q-جمع کرانے کا نمبر کیا ہے؟
تمام Q- گذارشات کو موصول ہونے پر "Q" سے شروع ہونے والا دستاویز نمبر تفویض کیا جاتا ہے (یعنی Qyyxxxx)۔ نمبر کا فارمیٹ جمع کرانے کے سال کے لیے 2 ہندسوں (یعنی "yy") پر مشتمل ہے (مثال کے طور پر، "23" برائے 2023) اور 4 ہندسوں (یعنی، "xxxx") جو درج ذیل ترتیب وار نمبر ہیں اس کیلنڈر سال کے لیے ایف ڈی اے۔ لہذا، جنوری 2023 میں ایف ڈی اے کی طرف سے موصول ہونے والی پہلی Q-سبمیشن Q230001 ہے، اور عام طور پر ہر سال 3,500 سے 4,000 نئی گذارشات موصول ہوتی ہیں۔ اگر مضمون کا آلہ گزشتہ Q-جمع کرانے میں جمع کرایا گیا تھا، تو اصل دستاویز نمبر دوبارہ استعمال کیا جاتا ہے، اور ایک ضمیمہ نمبر شامل کیا جاتا ہے (یعنی، Qyyxxx/S001، Qyyxxx/S002، وغیرہ)۔ Q-سبمیشن نمبرنگ کی مزید تفصیل میں وضاحت کی گئی ہے۔ 2023 FDA رہنمائی.
کیا FDA Q- گذارشات کے لیے چارج کرتا ہے؟
FDA پری جمع کرانے کے لیے FDA یوزر فیس (یعنی $0) ادا کرنے کی ضرورت نہیں ہے۔
FDA پری جمع کرانے میں کتنا وقت لگتا ہے؟
اسکویشنگ ٹائم لائنز کے دن چلے گئے ہیں. ٹائم لائن ہے۔ 70-75 کیلنڈر کے دن. 5 اکتوبر 2022 کو، MDUFA V منظور کیا گیا تھا. MDUFA V کے فیصلے کے اہداف میں سے ایک کے طور پر، FDA کو 70% پری ذیلی درخواستوں کے لیے 90 دنوں کے اندر پری ذیلی سوالات کا جواب دینے کی ٹائم لائن کو کم کرنے کا کام سونپا گیا ہے۔ FDA کو مارچ 2024 تک اس ہدف کو حاصل کرنے کا کام سونپا گیا ہے۔ اگر وہ کامیاب ہو جاتے ہیں تو FDA 59 میں اپنے بجٹ میں 2024 ہیڈ کاؤنٹ کا اضافہ حاصل کرے گا۔ یہ تقریباً 19 ملین ڈالر کی ترغیب ہے جو 70 کے اندر آپ کے جمع کرانے سے پہلے کی میٹنگ کے سوالات کا جواب دے گی۔ دن. ان نئے MDUFA V فیصلے کے اہداف کی عکاسی کرنے کے لیے، FDA نے اپ ڈیٹ کیا۔ Q- ذیلی رہنمائی ای میل کے جواب کے لیے 70 دن اور ٹیلی کانفرنس میٹنگز کے لیے 75 دن کی ہدف کی تاریخ کو ظاہر کرنے کے لیے دستاویز۔ FDA نے FDA پیشگی جمع کرانے کی آخری تاریخوں کو ٹریک کرنے میں سہولت فراہم کرنے کے لیے کسٹمر کولابریشن پورٹل (CCP) کو بھی اپ ڈیٹ کیا۔
FDA PreSTAR کیا ہے؟
ماضی میں، آپ کو ایف ڈی اے کی پیشگی جمع کرانے کے لیے اپنا اپنا دستاویز (دستاویزات) بنانا پڑتا تھا۔ کچھ لوگ ایک بڑی PDF دستاویز بناتے ہیں جسے حصوں میں تقسیم کیا جاتا ہے، جبکہ دوسرے FDA پری جمع کرانے کی رہنمائی کی ہر ضرورت کے لیے علیحدہ PDF دستاویزات بناتے ہیں۔ 6 جون 2023 کو، ایف ڈی اے نے بیٹا ورژن جاری کیا (یعنی، ورژن 0.1) ایک نئے پی ڈی ایف ٹیمپلیٹ کا (یعنی، ایف ڈی اے پریسٹار)۔ یہ نیا PreSTAR ٹیمپلیٹ FDA کو متعدد فوائد فراہم کرتا ہے:
- ہر کمپنی ایک ہی فارمیٹ استعمال کرتی ہے،
- ٹیمپلیٹ خود بخود تصدیق کرتا ہے کہ پیشگی جمع کرانے میں تمام مطلوبہ عناصر شامل ہیں، اور
- اختیاری عناصر کی شمولیت کمپنیوں کو ڈیوائس کی مزید تفصیلات فراہم کرنے کی ترغیب دے گی جو وہ دوسری صورت میں فراہم کر سکتی ہیں۔
PreSTAR جمع کرانے والوں کو بھی فائدہ دیتا ہے:
- آپ FDA پری جمع کرانے کے مطلوبہ عناصر کو کبھی نہیں بھولیں گے،
- آپ کو کبھی بھی FDA eCopy کی توثیق کرنے کی ضرورت نہیں ہے، اور
- اسی طرح کا فارمیٹ اور یوزر انٹرفیس آپ کو FDA eSTAR استعمال کرنے کی تربیت دے گا۔
نوٹ: 1 اکتوبر 2023، FDA eSTAR کے نفاذ کی آخری تاریخ ہے۔
کیا آپ کو PreSTAR ٹیمپلیٹ استعمال کرنا ہے؟
Nope کیا. PreSTAR ورژن 0.1 بیٹا ورژن ہے اور 100% اختیاری ہے۔ تاہم، مجھے یہ میری اپنی ٹیمپلیٹس سے بہتر پسند ہے۔ آپ کی ڈیزائن ٹیم کے پاس اب بھی صارف دستی، ڈیوائس کی تفصیل، اور ٹیسٹنگ پلان کے لیے انفرادی دستاویزات ہو سکتی ہیں۔ ہم دستاویز کو اس بٹن کا استعمال کرتے ہوئے منسلک کرتے ہیں جو کہتا ہے "اٹیچمنٹ شامل کریں" (نیچے اسکرین کیپچر دیکھیں)۔

PreSTAR ٹیمپلیٹ پیٹرک مکاتنگا نے بنایا تھا، جو کہ لائف سائیکل ٹولز اور ٹیمپلیٹس ٹیم پر ایف ڈی اے میں کام کرنے والے ٹولز اور ٹیمپلیٹس انجینئر ہیں۔ ٹیمپلیٹ کے بارے میں سوالات کو کہاں بھیجنا ہے اس میں مدد کرنے کے لیے، اس نے مشورہ دیا:
- اگر آپ کے پاس CDRH کے ذریعے ریگولیٹ کیے گئے طبی آلات کے لیے eSTAR کے رضاکارانہ استعمال کے بارے میں سوالات یا تاثرات ہیں، یا اگر آپ کے طبی آلات کے بارے میں عمومی سوالات ہیں، تو براہ کرم رابطہ کریں۔ ڈویژن آف انڈسٹری اینڈ کنزیومر ایجوکیشن (DICE).
- اگر آپ کو CDRH کے ذریعے ریگولیٹ کیے جانے والے طبی آلات کے لیے eSTAR ٹیمپلیٹ میں کوئی خرابی یا خامیاں نظر آتی ہیں، تو براہ کرم رابطہ کریں۔ [ای میل محفوظ].
- اگر آپ کے پاس 510(k)s، De Novo کی درخواستوں، یا CDRH کے ذریعے ریگولیٹ کردہ طبی آلات کے لیے ابتدائی جمع کرانے کی درخواستوں کے بارے میں سوالات ہیں، تو براہ کرم رابطہ کریں۔ [ای میل محفوظ].
آپ eCopy کیسے جمع کراتے ہیں؟
آپ الیکٹرانک میڈیا (مثال کے طور پر USB فلیش ڈرائیو) پر ایک FDA eCopy جمع کر سکتے ہیں اور FedEx کے ذریعے FDA دستاویزی مرکز کو درج ذیل پتے پر بھیج سکتے ہیں: محکمہ خوراک وادویات، سینٹر فار ڈیوائسز اینڈ ریڈیولاجیکل ہیلتھ، ڈاکیومنٹ میل سینٹر، 10903 نیو ہیمپشائر ایوینیو، بلڈنگ۔ 66، آر ایم۔ G609, Silver Spring, MD 20993-0002۔ تاہم، آپ ویب براؤزر کے ذریعے FDA eCopy بھی جمع کروا سکتے ہیں (یعنی CCP… PreSTAR جمع کرنے کے طریقہ کے بارے میں اگلا سیکشن دیکھیں)۔
اگر آپ ایف ڈی اے پریسٹار کے بجائے سی سی پی کے ذریعے ایک کاپی جمع کر رہے ہیں۔
آپ PreSTAR کیسے جمع کراتے ہیں؟
آپ کے پاس FDA پری جمع کرانے کے لیے دو اختیارات ہیں:
- پری سب کو الیکٹرانک میڈیا پر محفوظ کریں (جیسے USB فلیش ڈرائیو) اور اسے FedEx کے ذریعے FDA کو بھیجیں، اور
- نئے FDA کسٹمر کولابریشن پورٹل (CCP) پر پری سب اپ لوڈ کریں۔
[سرایت مواد]
جیسا کہ آپ اوپر کی ویڈیو سے اندازہ لگا سکتے ہیں، ہم FDA پری جمع کرانے کے لیے صرف آپشن 2 استعمال کر رہے ہیں۔ آپشن 2 کے لیے، آپ ایک eCopy (زپ فائل کے طور پر محفوظ کردہ) یا ایک PreSTAR (مقامی پی ڈی ایف فارمیٹ میں) اپ لوڈ کر سکتے ہیں۔ نیچے دی گئی تصویر آپ کو دکھاتی ہے کہ یہ کیسے کیا جاتا ہے، لیکن اپ لوڈ کرنے کے عمل میں عام طور پر تقریباً ایک منٹ لگتا ہے – آپ کی فائل کے سائز اور بینڈوتھ پر منحصر ہے۔ آپ کر سکتے ہیں۔ رجسٹر آپ کے اپنے CCP اکاؤنٹ کے لیے سیکنڈوں میں۔

پیشگی جمع کرانے کا عمل کیا ہے؟
اپنی FDA پری جمع کرانے کی میٹنگ کی درخواست کی تیاری اور اپ لوڈ کرنا اس عمل کا صرف پہلا مرحلہ ہے۔ آپ کو ایک خودکار ای میل موصول ہوگی جس میں اس بات کی تصدیق کی جائے گی کہ آپ کی پیشگی جمع کرانے کو کامیابی کے ساتھ اپ لوڈ کیا گیا تھا، اور پھر آپ کو ای میل کے ذریعے ایک خودکار خط موصول ہوگا جو آپ کو تفویض کردہ Q-sub نمبر فراہم کرے گا۔ آپ کو ایک خودکار ای میل بھی موصول ہوگی جس میں آپ کو مطلع کیا جائے گا کہ پیشگی جمع کرانے کو قبول کر لیا گیا ہے، یا اگر تبدیلیوں کی ضرورت ہوئی تو FDA کا جائزہ لینے والا آپ سے رابطہ کرے گا۔ تفویض کردہ FDA جائزہ لینے والا عام طور پر پہلے تین ہفتوں کے اندر آپ سے بذریعہ ای میل رابطہ کرے گا اگر آپ نے درخواست کی ہے تو ٹیلی کانفرنس شیڈول کریں، لیکن پیش کردہ تاریخ/وقت عام طور پر FDA ٹیم کی دستیابی سے میل نہیں کھاتا، اور متبادل تاریخیں/وقت پیش کیے جا سکتے ہیں۔
آپ کو FDA کی طرف سے موصول ہونے کے 70 دنوں کے اندر اپنے ہر سوال کے لیے FDA کی طرف سے ایک ای میل جواب موصول ہوگا۔ اگر آپ نے ٹیلی کانفرنس کی درخواست کی ہے، تو یہ عام طور پر FDA پری جمع کرانے کی میٹنگ کی درخواست کی وصولی کے بعد تقریباً 75 ہوگی۔ آپ کی ٹیم کو ایک گھنٹے کی ٹیلی کانفرنس کے لیے تفصیلی بحث کا منصوبہ تیار کرنے کی ضرورت ہے۔ مواصلات کی سہولت کے لیے سلائیڈ ڈیک کی بہت سفارش کی جاتی ہے لیکن اس کی ضرورت نہیں ہے۔ اگر آپ سلائیڈ ڈیک فراہم کرتے ہیں، تو آپ کو اسے میٹنگ سے پہلے جائزہ لینے والے کو ای میل کرنا چاہیے۔ آپ کو اپنے میٹنگ منٹس کے ساتھ سلائیڈ ڈیک کی ایک کاپی بھی فراہم کرنی ہوگی۔ ٹیلی کانفرنس کے آغاز میں، آپ کی ٹیم میں سے کسی کو 15 دنوں کے اندر FDA کو میٹنگ منٹس کا مسودہ جمع کرانے کا عہد کرنا چاہیے۔ FDA آپ کی میٹنگ منٹس کی منظوری کے ساتھ جواب دے گا، یا وہ ایک ترمیم شدہ ورژن فراہم کرے گا۔ ایف ڈی اے کے لیے تفصیلی پروٹوکول اور نئے سوالات کے ساتھ ایک ضمنی FDA پری جمع کروانا بھی عام ہے۔
میں پوسٹ کیا گیا: پری اسٹار
- SEO سے چلنے والا مواد اور PR کی تقسیم۔ آج ہی بڑھا دیں۔
- پلیٹو ڈیٹا ڈاٹ نیٹ ورک ورٹیکل جنریٹو اے آئی۔ اپنے آپ کو بااختیار بنائیں۔ یہاں تک رسائی حاصل کریں۔
- پلیٹوآئ اسٹریم۔ ویب 3 انٹیلی جنس۔ علم میں اضافہ۔ یہاں تک رسائی حاصل کریں۔
- پلیٹو ای ایس جی۔ آٹوموٹو / ای وی، کاربن، کلین ٹیک، توانائی ، ماحولیات، شمسی، ویسٹ مینجمنٹ یہاں تک رسائی حاصل کریں۔
- بلاک آفسیٹس۔ ماحولیاتی آفسیٹ ملکیت کو جدید بنانا۔ یہاں تک رسائی حاصل کریں۔
- ماخذ: https://medicaldeviceacademy.com/fda-pre-submission/
