发布者 罗伯·帕卡德 on 2023 年 6 月 28 日
FDA 预提交的格式和内容要求没有改变,但 FDA PreSTAR 的推出改变了一切。
[嵌入的内容]
什么是 FDA 预提交?
FDA 预提交旨在获得您对未来 FDA 提交的疑问的答案。 预提交可以包含一份大型 PDF 文档或多份 PDF 文档。 在预提交中,您必须选择电子邮件回复或通过电话会议进行电子邮件回复。 选择电话会议的优点之一是,您可以在与 FDA 进行一小时的电话会议期间提出澄清问题,但您有责任在电话会议后 15 天内向 FDA 提交会议纪要草稿。 如果您选择电子邮件回复,则无需向 FDA 提供会议纪要。 5 年 2023 月 4 日,我们将启动新的由 XNUMX 部分组成的 FDA 提交前网络研讨会系列。 这将是 终极 FDA 提交前培训。 不要错过。
FDA 预提交和 Q 提交有什么区别?
每个 FDA 预提交都是 Q 提交,但并非所有 Q 提交都是预提交。 新的 PreSTAR 模板目前仅限于 FDA 预提交,但该模板稍后将扩展到其他类型的 Q-sub。 FDA 预提交模板(即 PreSTAR)测试版 0.1 不需要用于回答 FDA 的交互式审查问题。 只需向首席审阅者发送电子邮件即可(电子邮件的文件大小限制为 25 MB)。
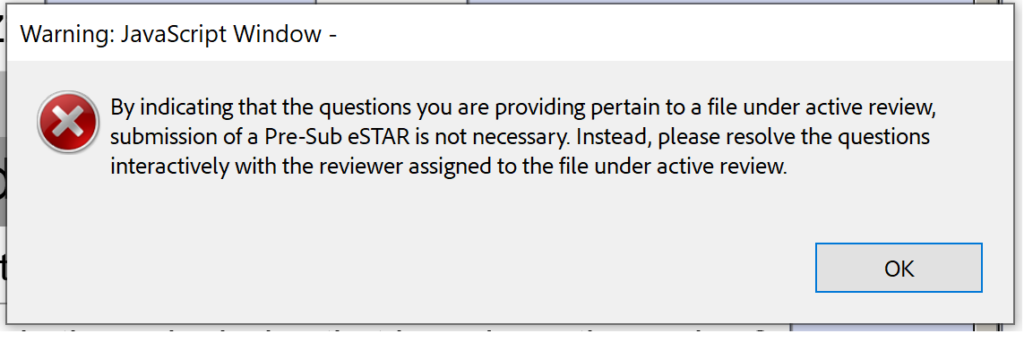
不幸的是,测试版 0.1 还没有准备好进行提交审核 (SIR) 会议或在交互式审核期间对 IDE 的响应。
13 种其他类型的提交可能会受益于 Q 提交:
- 提交问题请求 (SIR)
- 研究风险测定
- 信息会议
- 突破性器械指定请求
- 信息会议
- PMA 第 100 天会议
- 协议和决定会议
- 与 STeP 计划相关的提交内容
- 配件分类要求
- 请求 FDA 对具体问题或跨领域政策事项提供反馈
- 请求承认可公开访问的遗传变异数据库
- 组合产品协议会议 (CPAM),以及
- 对 FDA 483 检查观察结果的反馈。
我们预计 PreSTAR 模板最终可用于未来的 513(g) 请求,因为它已经为此目的进行了验证。
Q 提交编号是多少?
所有 Q 提交在收到时都会分配一个以“Q”开头的文档编号(即 Qyyxxxx)。 编号的格式由表示提交年份的 2 位数字(即“yy”)(例如,“23”表示 2023 年)和 4 位数字(即“xxxx”)组成,这些数字是由以下分配的顺序号该日历年的FDA。 因此,FDA 在 2023 年 230001 月收到的第一份 Q 申请是 Q3,500,每年通常会收到 4,000 至 001 份新申请。 如果主题设备是在之前的Q提交中提交的,则重新使用原始文档编号,并添加补充编号(即Qyyxxx/S002、Qyyxxx/SXNUMX等)。 Q-提交编号在 2023 年 FDA 指南.
FDA 对 Q 提交收费吗?
FDA 预提交不需要支付 FDA 用户费(即 0 美元)。
FDA 预提交需要多长时间?
时间紧迫的日子已经一去不复返了。 时间线是 70-75 日历日。 5 年 2022 月 XNUMX 日, MDUFA V 被批准。 作为 MDUFA V 决策目标之一,FDA 的任务是缩短 70% 的 pre-sub 请求在 90 天内回复 pre-sub 问题的时间。 FDA 的任务是在 2024 年 59 月之前实现这一目标。如果成功,FDA 将在 2024 年的预算中增加 19 名员工。这大约是 70 万美元的奖励,用于在 XNUMX 天内回答您的提交前会议问题。天。 为了反映这些新的 MDUFA V 决策目标,FDA 更新了 Q-Sub 指导 文件反映电子邮件回复的目标日期为 70 天,电话会议的目标日期为 75 天。 FDA 还更新了客户协作门户 (CCP),以方便跟踪 FDA 预提交截止日期。
什么是 FDA PreSTAR?
过去,您必须为 FDA 预提交创建自己的文件。 有些人创建一个分为多个部分的大型 PDF 文档,而另一些人则为 FDA 提交前指南的每项要求创建单独的 PDF 文档。 6年2023月XNUMX日,FDA发布了测试版(即 0.1版)新的 PDF 模板(即 FDA PreSTAR)。 这个新的 PreSTAR 模板为 FDA 提供了多种好处:
- 每个公司都使用相同的格式,
- 模板自动验证预提交是否包含所有必需的元素,并且
- 纳入可选元素将鼓励公司提供更多的设备详细信息。
PreSTAR 还使提交者受益:
- 您永远不会忘记 FDA 预提交所需的要素,
- 您无需验证 FDA 电子副本,并且
- 类似的格式和用户界面将训练您使用 FDA eSTAR。
注:1 年 2023 月 XNUMX 日是 FDA eSTAR 实施截止日期。
必须使用 PreSTAR 模板吗?
没有。 PreSTAR 0.1 版是测试版,100% 可选。 不过,比起我自己的模板,我更喜欢它。 您的设计团队仍然可以拥有用户手册、设备描述和测试计划的单独文档。 我们使用“添加附件”按钮附加文档(请参见下面的屏幕截图)。

PreSTAR 模板由 Patrick Macatangga 构建,他是 FDA 生命周期工具和模板团队的工具和模板工程师。 为了帮助解决有关模板的问题,他建议:
- 如果您对 CDRH 监管的医疗器械自愿使用 eSTAR 有疑问或反馈,或者如果您对医疗器械有一般性问题,请联系 工业和消费者教育部 (DICE).
- 如果您发现 CDRH 监管的医疗器械 eSTAR 模板有任何故障或错误,请联系 [电子邮件保护].
- 如果您对 CDRH 监管的医疗器械的 510(k)s、De Novo 请求或提前提交请求有疑问,请联系 [电子邮件保护].
如何提交电子副本?
您可以通过电子介质(例如 USB 闪存驱动器)提交 FDA 电子副本,并通过 FedEx 将其发送至 FDA 文档中心,地址如下: 食品和药物管理局, 设备和放射健康中心,文件邮件中心,10903 New Hampshire Ave., Bldg. 66,rm。 G609,银泉,MD 20993-0002。 但是,您也可以通过网络浏览器提交 FDA 电子副本(即 CCP……请参阅下一节,了解如何提交 PreSTAR)。
如果您通过 CCP 提交电子副本而不是 FDA PreSTAR
如何提交 PreSTAR?
您有两种提交 FDA 预提交的选择:
- 将预分项保存在电子介质(例如 USB 闪存驱动器)上并通过 FedEx 将其发送至 FDA,以及
- 将预分录上传到新的 FDA 客户协作门户 (CCP)。
[嵌入的内容]
正如您从上面的视频中可以猜到的那样,我们仅对 FDA 预提交使用选项 2。 对于选项 2,您可以上传 eCopy(另存为 zip 文件)或 PreSTAR(原始 PDF 格式)。 下图向您展示了如何完成此操作,但上传过程通常需要大约一分钟 - 取决于您的文件大小和带宽。 你可以 寄存器 几秒钟内即可创建您自己的 CCP 帐户。

预提交流程是什么?
准备并上传 FDA 提交前会议请求只是该流程的第一步。 您将收到一封自动电子邮件,确认您的预提交已成功上传,然后您将通过电子邮件收到一封自动信件,其中包含分配的 Q-sub 号码。 您还将收到一封自动电子邮件,通知您预提交已被接受,或者如果需要更改,FDA 审核员将与您联系。 如果您要求的话,指定的 FDA 审核员通常会在前三周内通过电子邮件与您联系,安排电话会议,但提供的日期/时间通常与 FDA 团队的空闲时间不匹配,并且可能会提供替代日期/时间。
您将在 FDA 收到您的每个问题后 70 天内收到 FDA 的电子邮件回复。 如果您请求召开电话会议,通常会在收到 FDA 提交前会议请求后 75 小时左右。 您的团队需要为一小时的电话会议准备详细的讨论计划。 强烈建议使用幻灯片以促进沟通,但不是必需的。 如果您提供幻灯片,您应该在会议之前通过电子邮件将其发送给审阅者。 您还需要提供包含会议纪要的幻灯片副本。 在电话会议开始时,您团队中的某人必须承诺在 15 天内向 FDA 提交会议纪要草案。 FDA 将回复接受您的会议纪要,或者他们将提供经过编辑的版本。 在 FDA 提交前提交一份补充文件也是很常见的,其中包含详细的方案和 FDA 的新问题。
发表在: 预星
